Решение задач по химии на расчет эквивалентных масс реагирующих веществ
Задача 439.
Имеется раствор, в 1 л которого содержится 18,9 г HNO3, и раствор, содержащий в 1 л 3,2 г NaOH. В каком объемном отношении нужно смешать эти растворы для получения раствора, имеющего нейтральную реакцию?
Решение:
Уравнение реакции нейтрализации гидроксида натрия азотной кислотой имеет вид:
HNO3 + NaOH = NaNO3 + H2O
Вещества реагируют в эквивалентных отношениях 1 : 1, что указывает на то, что эквивалентные массы реагирующих друг с другом веществ численно равны их молекулярным массам:
M(NaOH) = 40г/моль;
M(HNO3) = 63г/моль.
Найдём количество HNO3 и NaOH в литровых растворах:
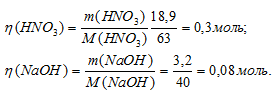
NaOH взят в недостатке, поэтому нужно некоторое количество его для нейтрализации HNO3. Обозначим объём раствора NaOH через x. Тогда общее количество раствора NaOH можно записать как 0,08х. Количество HNO3 должно быть равно количеству NaOH, Поскольку по уравнению реакции количества NaOH и HNO3 равны, то можно записать:
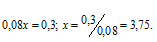
Можно составить пропорцию:
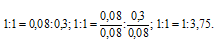
Ответ: 1 : 3,75.
Задача 440.
Какой объем 0,2н. раствора щелочи потребуется для осаждения в виде Fe(OH)3 всего железа, содержащегося в 100 мл 0, 5 н. раствора FeCl3?
Решение:
В 100 мл 0,5 н раствора содержится 0,05 эквивалента FeCl3 (0,1 . 0,5 = 0,05). Обозначим нужный объём 0,2 н раствора щёлочи через x, тогда в этом растворе содержится 0,2 Н эквивалента щёлочи. Поскольку вещества реагируют в эквивалентных количествах, то можно записать:
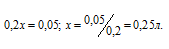
Ответ: 0,25 л.
Задача 441.
Сколько граммов СаСО3 выпадает в осадок, если к 400 мл 0,5 н. раствора СаСI2 прибавить избыток раствора соды?
Решение:
Уравнение реакции имеет вид:
СаСI2 + Na2CO3 ⇔ CaCO3 + 2NaCl
Из уравнения реакции следует, что на получение 1 моля СаСО3 требуется 1 моль СаСI2. Находим количество эквивалентов СаСО3 в 400 мл 0,5 Н раствора:
0,4 . 0,5 = 0,2 Н
Такое же количество СаСО3 выпадает в осадок. Молярная масса эквивалента соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:
 где
где
МЭ(В) - молярная масса эквивалента соли, г/моль; М(В) - молярная масса соли; n - коэффициент при атоме металла; А - валентность металла.
Отсюда
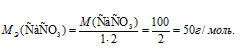
Теперь рассчитаем массу выпавшего осадка CaCO3 : 0,2 . 50 = 10 г.
Ответ: 10 г.
Задача 442. Для нейтрализации 20 мл 0,1Н. раствора кислоты потребовалось 8 мл раствора NaOН. Сколько граммов содержит 1 л этого раствора?
Решение:
Для вычисления нормальности раствора NaOH используем математическое выражение следствия из закона эквивалентности (так называемое правило пропорциональности):
CЭ(А) . V(A) = CЭ(B) . V(B),
где
CЭ(А) и CЭ(B) - нормальные концентрации эквивалентов веществ А и В, моль/л; V(A) и V(B) - объёмы растворов веществ А и В.
По условию задачи известны V(щелочи), V(кислоты) и СЭ(кислоты), то нетрудно вычислить СЭ(щелочи) по формуле:
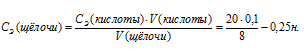
Эквивалентная масса NaOH равна его молярной массе, т.е. 40 г/моль. Тогда массу NaOH, содержащегося в 1 л раствора можно определить по формуле:
m(NaOH) = M(NaOH) . СЭ(NaOH) =
= 40 . 0,25 = 10 г.
Ответ: 10 г.

