Закон зквивалентов. Определение эквивалентной массы вещества
Задача № 19.
От чего зависит эквивалент химического элемента: а) от валентности элемента; б) всегда является постоянной величиной?
Решение:
Эквивалентом химического элемента называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает тоже количество атомов водорода в химических реакциях. Эквивалентной массой элемента называется масса одного эквивалента элемента. Эквивалент химического элемента (эквивалентная масса элемента) можно вычислить по составу соединения данного элемента с любым другим, эквивалент которого известен. Так, например, в оксиде меди(I) Cu2O и в оксиде меди(II) CuO эквивалентные массы меди будут различны: в CuO эквивалент меди рассчитывается из того, что 1моль кислорода соединяется с одним молем меди, а в соединении Cu2O – один моль кислорода соединяется с двумя молями меди. Отсюда, учитывая, что эквивалентная масса кислорода известна (8г/моль) и, зная, что валентность кислорода равна двум, можно рассчитать эквивалентную массу меди её валентность в оксидах CuO и Cu2O. Значит, в CuO валентность меди равна 2, а в Cu2O – 1. Тогда в CuO эквивалентная масса меди равна:
mЭ(Cu) = M/2 = 63,54/2 = 31,77г/моль,
а в Cu2O - mЭ(Cu) = M/1 = 63,54/1 = 63,54г/моль
Таким образом, эквивалентная масса элемента зависит от его валентности в данном химическом соединении.
Ответ: а).
Задача № 20.
Какая формула правильно выражает закон эквивалентов:
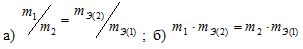
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
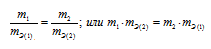
Формула
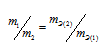
не соответствует пропорциональности, т.е.
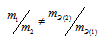
Формула
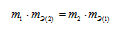
соответствует пропорциональности, т.е.
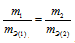
Таким образом, формула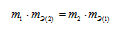 (правильно выражает закон эквивалентов.
(правильно выражает закон эквивалентов.
Ответ: б)
Задача № 21.
Фосфор образует два различных по составу хлорида. Эквивалент какого элемента сохраняется в этих соединениях постоянным: а) хлора; б) фосфора?
Решение:
Атом хлора на внешнем электронном слое содержит семь электронов, а атом фосфора – пять. Хлор наиболее электроотрицательный элемент, чем фосфор. Поэтому атом хлора способен оттягивать электронную плотность от атома фосфора на себя. Распределение электронов внешнего энергетического уровня хлора ...3s23p5, а атома фосфора …3s23p3 (учитывая правило Хунда, соответственно +17Cl 3s23p2x3p2y3p1z; +15P3s23p1x3p1y3p1z. В одном хлориде фосфор отдаёт три неспаренных p –электрона, а в другом – все пять электронов внешнего энергетического уровня. В случае отдачи трёх электронов фосфор проявляет валентность равную I, тогда mЭ(P) =M(P)/3 = 31/3 = 10,33г/моль. В случае отдачи пяти электронов фосфор проявляет валентность равную V, тогда mЭ(P) =M(P)/5 = 31/5 = 6,2г/моль. Хлор в обоих хлоридах фосфора, присоединяя один электрон проявляет валентность равную I т. е. mЭ(Cl) = M(Cl)/1 = 35,5/ = 35,5г/моль.
Таким образом, эквивалентная масса хлора в обоих соединениях будет иметь одно и тоже значение, а фосфора – два.
Ответ: а).
Задача № 22.
Выбрать правильные значения эквивалентных объемов кислорода и водорода при нормальных условиях: а) 11,2 л O2 и 22,4 л H2 б) 11,2 л O2 и 11,2 л H2 в.) 5,6 л O2 и 11,2 л H2.
Решение:
Эквивалентным объёмом называется объём, занимаемый при данных условиях одним эквивалентом вещества. Значение эквивалентного объёма вещества, находящегося в газообразном состоянии, зная, что в мольном объёме любого газа, состоящего из одноатомных молекул, содержится 1 моль атомов, а состоящего из двухатомных молекул – 2 моля атомов и т.д. Так, в 22,4л водорода содержится 2моля атомов, то
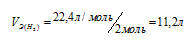
Кислород является двухвалентным элементом, поэтому его молекула будет присоединять или замещать четыре атома водорода т.е.
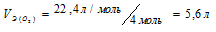
Ответ:
Задача № 23.
Эквивалентная масса металла равна 12 г/моль. Чему равна эквивалентная масса его оксида: а) 24 г/моль; б) нельзя определить; в) 20 г/моль?
Решение:
Оксид любого металла состоит из атома (атомов) металла, соединённых с атомом (атома-ми) кислорода согласно их валентности. Отсюда, учитывая, что эквивалентная масса оксида равна молярной массе оксида делённой на произведение числа атомов металла и числа его валентности в данном оксиде. Согласно закону эквивалентов эквивалентная масса оксида металла равна сумме эквивалентных масс металла и кислорода:
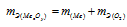
Учитывая, что 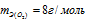 , можно рассчитать эквивалентную массу металла:
, можно рассчитать эквивалентную массу металла:
Ответ: а).
Задача № 24.
Эквивалентная масса металла в 2 раза больше, чем эквивалентная масса кислорода. Во сколько раз масса оксида больше массы металла: а) в 1,5 раза; б) в 2 раза; в) в 3 раза?
Решение:
Согласно закону эквивалентов эквивалентная масса оксида металла равна сумме эквивалентных масс металла и кислорода:
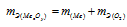
Эквивалентная масса кислорода известная величина, она равна 8 г/моль. По условию зада-чи эквивалентная масса металла в 2 раза больше, чем эквивалентная масса кислорода. Ис-ходя из этого, рассчитаем эквивалентную массу металла:
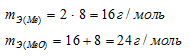
Согласно закону эквивалентов, массы оксида металла и металла пропорциональны их эквивалентным массам:
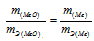
Отношение массы оксида металла к массе металла равно отношению их эквивалентных масс:
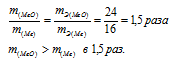
Ответ: а).
Задача № 25.
Сера образует хлориды S2Cl2 и SCl2, эквивалентная масса серы в SCl2 равна 16 г/моль. Выбрать правильное значение эквивалентной массы серы в S2Cl2: а) 8 г/моль; б) 16 г/моль; в) 32 г/моль.
Решение:
В соединениях S2Cl2 и SCl2 хлор проявляет степень окисления равную -1, т.е. валентность хлора в обоих соединениях равна 1, следовательно
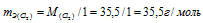
Так как в SCl2 на один атом серы приходится 2 моля хлора, то
mЭ(S) = M(S)/2 = 32/2 = 16г/моль.
то в соединении S2Cl2
mЭ(S) = M(S)/1 = 32/1 = 32г/моль. .
Ответ: в).
Задача № 26.
Одинаков ли эквивалент хрома в соединениях CrCl3 и Cr2(SO4)2: а) да; б) нет?
Решение:
Эквивалент элемента (Э) – это такое количество элемента, которое соединяется с 1 молем атома водорода или замещает то же количество атомов водорода в химических реакциях. Масса одного эквивалента элемента называется его эквивалентной массой (mЭ). Эквиваленты (Э) выражаются в молях, эквивалентные массы (mЭ) в г/моль. Эквивалентная масса элемента равна мольной массе элемента делённой на его валентность:
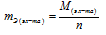
где
М – мольная (атомная) масса элемента; n – валентность или степень окисления элемента. Эквивалент элемента равен 1/n моль, где n – валентность или степень окисления элемента.
Хлор в соединениях CrCl3 и Cr2(SO4)2 имеет степень окисления (-1), значит, его эквивалент равен 1моль. Определим валентность хрома в соединениях CrCl3 и Cr2(SO4)2:
а) CrCl3 Валентность хрома равна III, так как хлор имеет степень окисления (-1), соответственно, хром – (-3);
б) Cr2(SO4)2 Заряд иона SO42- равен (2-). Поскольку в молекуле Cr2(SO4)2 имеется три иона SO42-, то заряд иона хрома составляет (3+). Следовательно, в обоих соединениях CrCl3 и Cr2(SO4)2 хром имеет валентность равную 3, т. е. в этих веществах хром имеет одинаковое значение эквивалента, а именно 1/3 моль.
Ответ: а) да.
Задача № 27.
Одинакова ли эквивалентная масса железа в соединениях FeCl2 и FeCl3: а) да; б) нет?
Решение:
Эквивалент элемента (Э) – это такое количество элемента, которое соединяется с 1 моль атома водорода или замещает то же количество атомов водорода в химических реакциях. Масса одного эквивалента элемента называется его эквивалентной массой (mЭ). Эквиваленты (Э) выражаются в молях, эквивалентные массы (mЭ) в г/моль. Эквивалентная масса элемента равна мольной массе элемента делённой на его валентность:
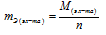
где
М – мольная (атомная) масса элемента; n – валентность или степень окисления эле-мента. Эквивалент элемента равен 1/n моль, где n – валентность или степень окисления элемента.
Хлор в соединениях FeCl2 и FeCl3 имеет степень окисления (-1), а железо, соответственно, (+2) и (+3). Следовательно, эквивалентная масса железа в FeCl2 равна:
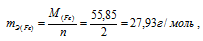
а в соединении FeCl3 – 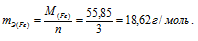
Ответ: б) нет.
Задача № 27.
Одинакова ли эквивалентная масса железа в соединениях FeCl2 и FeCl3: а) да; б) нет?
Решение:
Эквивалент элемента (Э) – это такое количество элемента, которое соединяется с 1 моль атома водорода или замещает то же количество атомов водорода в химических реакциях. Масса одного эквивалента элемента называется его эквивалентной массой (mЭ). Эквиваленты (Э) выражаются в молях, эквивалентные массы (mЭ) в г/моль. Эквивалентная масса элемента равна мольной массе элемента делённой на его валентность:
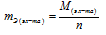
где
М – мольная (атомная) масса элемента; n – валентность или степень окисления эле-мента. Эквивалент элемента равен 1/n моль, где n – валентность или степень окисления элемента.
Хлор в соединениях FeCl2 и FeCl3 имеет степень окисления (-1), а железо, соответственно, (+2) и (+3). Следовательно, эквивалентная масса железа в FeCl2 равна:
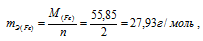
а в соединении FeCl3 – 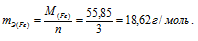
Ответ: б) нет.

