Характеристика свойств элементов по положению их в периодической системе
Задача 769.
По какому принципу элементы объединяются в группы и подгруппы?
Решение:
В вертикальных столбцах (или в группах) периодической системы химических элементов располагаются элементы,
обладающие сходным строением и сходными свойствами. Поэтому каждая вертикальная группа элементов представляет собой как бы естественное семейство элементов, Всего в таблице таких групп элементов восемь.
Элементы, входящие в группу, образуют оксиды сообразно их наибольшей валентности, которая равна, за немногим исключением, номеру группы.
Начиная с пятого ряда каждый элемент, обнаруживает наибольшее сходство не с элементом, расположенным непосредственно под или над ним, а с элементами, отделенными от него одной клеткой. Например, в первой группе рубидий не примыкает непосредственно к калию и цезию, а отделён от калия медью, а от цезия – серебром. Такая закономерность наблюдается во всех группах. Это объясняется тем, что с четвёртого ряда начинаются большие периоды, состоящие из двух рядов элементов, расположенных один над другим. направо, то понятно, что в каждом большом периоде у элементов верхнего (чётного) ряда они выражены сильнее, чем у элементов нижнего (начетного) ряда. Чтобы отметить различие между рядами, элементы первых рядов больших периодов сдвинуты в таблице влево, а элементы вторых – вправо.
Таким образом, начиная с четвёртого периода каждую группу периодической системы можно разбить на две подгруппы: «чётную», состоящую из элементов верхних рядов, и «нечётную», образованную элементами нижних рядов. Что же касается элементов малых периодов, то в первой и второй группах они ближе примыкают по своим свойствам к элементам чётных рядов и сдвинуты влево, в других – к элементам нечётных рядов и сдвинуты вправо. Поэтому элементы малых периодов (типические элементы) обычно объединяют со сходными с ними элементами чётных или нечётных рядов в одну главную подгруппу, а другая подгруппа называется побочной.
При построении периодической системы химических элементов Д.И. Менделеев руководствовался принципом расположения элементов по возрастающим атомным массам. В последствии было установлено, что элементы с одинаковыми конфигурациями валентных оболочек образуют вертикально расположенные в периодической системе подгруппы и группы. Так у всех элементов главных подгрупп заполняются либо внешние ns - оболочки (I и II группы) – эти элементы называются s – элементами, либо внешние np – оболочки (III и IV группы); такие элементы называют р – элементами. У элементов побочных подгрупп заполняются внутренние (n – 1)d – оболочки. Элементы побочных подгрупп образуют вставные декады – 21(Sc) – 30(Zn); 39(Y) – 48(Cd); 57(La), 72(Hf) – 80(Hg); начало четвёртой вставной декады 89(Ас) – в незавершённом 7 периоде. Элементы этих декад называют d – элементами. Элементы ряда лантана и актиния вынесены отдельно и расположены внизу таблиц и названы соответственно «лантаноиды» и «актиноиды». У элементов 58(Се) – 71(Lu) и актиноидов 90(Th) – 103(Lr) происходит заполнение (n – 2)f - оболочек, поэтому эти элементы называют f – элементами.
Задача 770.
Почему у элемента VII группы марганца преобладают металлические свойства, тогда как стоящие в той же группе галогены являются типичными неметаллами? Дать ответ, исходя из строения атомов указанных элементов.
Решение:
Марганец имеет конфигурацию валентного слоя: 3d54s2, т.е. в наружном электронном слое находятся всего два s-электрона, то в отличие от марганца и его аналогов, образуют соединения с водородом. Однако высшие соединения марганца и галогенов до некоторой степени сходны, так как в образовании связей с кислородом у марганца, как у галогенов, могут участвовать семь электронов, два (4 s-электрона) с наружного 4s- и пять (3d-электрона) с предпоследнего 3d-подуровня. Поэтому у марганца высшая степень окисления, как и у галогенов, равна +7.
Таким образом, склонность к отдаче электронов характеризует марганец и его аналоги как типичные металлы, а склонность к присоединению электронов характеризует галогены как типичные неметаллы.
Задача 771.
Как изменяются валентные возможности и координационные числа элементов главных подгрупп с ростом заряда ядер их атомов? Разобрать на примере элементов VI группы. Написать формулы серной, селеновой и теллуровой кислот.
Решение:
Общая электронная формула валентных подуровней элементов VIА-подгруппы ns2np4. Появление новых электронных слоёв с увеличением заряда ядер их атомов влечёт за собой увеличение радиуса атомов, уменьшение электроотрицательности, понижение окислительной активности незаряжённых атомов и усиление восстановительных свойств атомов со степенью окисленности равной 2. В целом с ростом заряда ядер атомов в главных подгруппах закономерно уменьшаются энергии ионизации и сродство к электрону.
Атом кислорода отличается от атомов других элементов подгруппы отсутствием d-подуровня во внешнем электронном слое:
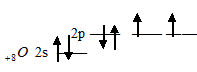
Такая электронная структура атома кислорода не позволяет атому распаривать электроны, поэтому ковалентность кислорода, как правило, равна 2 (число неспаренных валентных электронов). Атомы +16S, +34Se, +52Te и +84Po на валентном электронном слое имеют свободные d-орбитали:
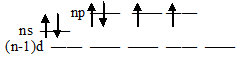
Такая электронная структура атомов позволяет атомам данных элементов распаривать электроны, поэтому в возбуждённом состоянии число неспаренных электронов увеличивается за счёт перевода s- и р- электронов на свободные d-орбитали. В связи с этим указанные элементы проявляют ковалентность равную не только 2, но и 4, и 6:
а) (ковалентность – 4) 
б) (ковалентность – 4) 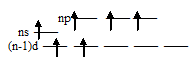
С ростом заряда ядер атомов закономерно увеличиваются ионные радиусы, что увеличивает и координационные числа элементов. Формулы серной, селеновой и теллуровой кислот соответственно имеют вид: H2SO4, H2SeO4, H2TeO4.
Задача 772.
Как изменяется устойчивость высших оксидов и гидроксидов в главных и побочных подгруппах с ростом заряда ядер атомов элемента? Ответ подтвердить примерами.
Решение:
В главных подгруппах радиусы атомов растут при переходе от элементов сверху вниз, так как возрастает число электронных слоев.
В побочных подгруппах при переходе от первого элемента ко второму происходит возрастание атомного радиуса, а при переходе от второго к третьему — иногда даже некоторое уменьшение. Так, в подгруппе титана Ti Zr, Hf соответственно равны 146, 160, 159 нм. Это объясняется лантаноидным сжатием.
Общими для элементов главных и побочных подгрупп являются формулы высших оксидов (и их гидратов). У высших оксидов и их гидратов элементов I - III групп (кроме бора) преобладают основные свойства, с IV по VIII - кислотные. Например, в группе IA все элементы образуют основные оксиды и гидроксиды, но наиболее резко основной характер выражен у элемента франция. Основные свойства усиливаются в ряду:
LiOH → NaOH → KOH → RbOH → CsOH.
ВеО – амфотерный оксид.
Оксиды Mg, Ca, Sr, Ba – основные оксиды.
Основные свойства усиливаются в ряду:
Ве(ОН)2→ Mg(ОН)2 → Ca(ОН)2 → Sr(ОН)2 → Вa(ОН)2.
Гидроксид цинка также проявляет амфотерные свойства. Он нерастворим в воде, но растворяется в кислотах и щелочах:
Zn(OH)2 + 2HCl → ZnCl2 + 2H2O;
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4].
Оксид кадмия СdО (коричневого цвета) и гидроксид кадмия Сd(ОН)2 (белого цвета) проявляют основной характер, растворяясь только в кислотах:
CdO + 2HCl → CdCl2 + H2O.
Если металл образует несколько гидроксидов, находясь в различной степени окисления, то чем выше степень окисления металла, тем более слабыми основными свойствами обладает гидроксид.
Так, Cr(OH)3 более слабое основание, чем Cr(OH)2.
По группе кислородосодержащих кислот сверху вниз сила кислот уменьшается. Так угольная H2CO3 более сильная, чем кремниевая H2SiO3.
Чем выше степень окисления кислотообразующего элемента, тем сильнее кислота:
H2S+6O4 → H2S+4O3,серная кислота сильнее, чем сернистая.

