Общие закономерности изменения свойств простых веществ. Диагональное сходство элементов
Свойства элементов 2-го периода
Задача 773.
Чем объясняется отличие свойств элементов 2-го периода от свойств их электронных аналогов в последующих периодах?
Решение:
Отличие свойств элементов 2-го периода от свойств их электронных аналогов в последующих периодах объясняется
тем, что атомы элементов 2-го периода во внешнем электронном слое не содержат d-подуровень. Например, элементы главной подгруппы VI группы: О, S, Se, Te, Po являются электронными аналогами, так как их атомы содержат на внешнем электронном слое по шесть электронов, два на s- и четыре на р- подуровне. Электронная конфигурация их валентного слоя имеет вид: ns2np4. Атом кислорода отличается от атомов других элементов подгруппы отсутствием d-подуровня во внешнем электронном слое:
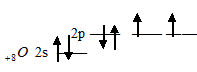
Такая электронная структура атома кислорода не позволяет атому распаривать электроны, поэтому ковалентность кислорода, как правило, равна 2 (число неспаренных валентных электронов). Здесь возрастание числа неспаренных электронов возможно только путём перевода электрона на следующий энергетический уровень, что, естественно, сопряжено с большой затратой энергии. Атомы элементов последующих периодов +16S, +34Se, +52Te и +84Po на валентном электронном слое имеют свободные d-орбитали:
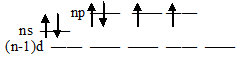
Такая электронная структура атомов позволяет атомам данных элементов распаривать электроны, поэтому в возбуждённом состоянии число неспаренных электронов увеличивается за счёт перевода s- и р- электронов на свободные d-орбитали. В связи с этим указанные элементы проявляют ковалентность равную не только 2, но и 4, и 6:
а) (ковалентность – 4)

б) (ковалентность – 4)
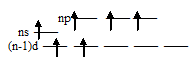
Поэтому в отличие от атома кислорода атомы серы, селена и теллура могут участвовать в образовании не только двух, но также четырёх или шести ковалентных связей. Аналогично ведут себя атомы других периодов, также обладающие незанятыми d- орбиталями, могут переходить в возбуждённое состояние и образовывать дополнительное число неспаренных электронов.
Диагональное сходство элементов
Задача 774.
В чем проявляется диагональное сходство элементов? Какие причины его вызывают? Сравнить свойства бериллия, магния и алюминия.
Решение:
Диагональное сходство — сходство между собой элементов, находящихся в Периодической системе элементов по диагонали друг от друга, а также соответствующих им про-стых веществ и соединений. Диагональ из левого верхнего угла к нижнему правому объединяет отчасти сходные элементы. Это объясняется приблизительно одинаковым увеличением неметаллических свойств в периодах и металлических свойств в группах. Диагональная аналогия может проявляться в двух формах: сходстве общего химического характера элементов, проявляющемся во всех однотипных соединениях. Диагональная аналогия в широком смысле обусловлена близостью энергетических и размерных характеристик элементов-аналогов. В свою очередь, это определяется немонотонным изменением, например, электроотрицательности и орбитальных радиусов элементов по горизонтали (в периоде) и по вертикали (в группе). В силу этой немонотонности и оказывается возможной такая ситуация, когда различие между характеристиками элементов по диагонали оказывается меньше, чем по горизонтали и по вертикали, что и приводит к большему химическому сходству диагонально расположенных элементов в соседних группах по сравнению с групповой аналогией. Сходство моэно объяснить близкими отношениями заряд/радиус иона.
Диагональное сходство наблюдается у пар элементов Li и Mg, Be и Al, B и Si и др. Эта закономерность обусловлена тенденцией смены свойств по вертикали (в группах) и их изменением по горизонтали (в периодах). Она связана с возрастание неметаллических свойств в периодах слева направо и в группах снизу вверх. Поэтому литий похож на магний, бериллий на алюминий, бор на кремний, углерод на фосфор. Так, литий и магний образуют много алкильных и арильных соединений, которые часто используют в органической химии. Бериллий и алюминий имеют сходные значения окислительно-восстановительных потенциалов. Бор и кремний образуют летучие, весьма реакционноспособные молекулярные гидриды.
Химические свойства бериллия во многом похожи на свойства магния (Mg) и, особенно, алюминия (Al). Близость свойств бериллия и алюминия объясняется почти одинаковым отношением заряда катиона к его радиусу для ионов Be2+ и Al3+. Ве – проявляет, подобно алюминию, амфотерные свойства.
У бериллия и алюминия отношение радиуса иона к заряду, 1/нм соответственно равны 45,4 и 41,7 гораздо больше, чем у магния - 24.4. У магния гидроксид среднее основание, а у бериллия и алюминия - амфотерные основания. У магния кристаллическая решётка хлорида ионная, а у бериллия и алюминия - молекулярная (безв.); ионная (кристаллогидрат). Гидрид магния ионное соединение, а гидриды бериллия и алюминия - полимеры.
Физические и химические свойства простых веществ элементов главных подгрупп
Задача 775.
Каковы общие закономерности изменения физических и химических свойств простых веществ, образуемых элементами главных подгрупп периодической системы элементов: а) в периоде; б) в группе?
Решение:
а) в периоде.
В периодах (слева направо) - заряд ядра возрастает, число электронных уровней не меняется и равно номеру периода, число электронов на внешнем слое возрастает, радиус атома уменьшается, восстановительные свойства уменьшаются, окислительные свойства возрастают, высшая степень окисления растет от +1 до +7, низшая степень окисления растет от -4 до +1, металлические свойства веществ ослабевают, неметаллические свойства - усиливаются. Это связано с увеличением числа электронов на последнем слое. В периодах слева направо у высших оксидов и их гидратов основные свойства уменьшаются, а кислотные увеличиваются.
б) в группе.
В главных подгруппах (сверху вниз) - заряд ядра возрастает, число электронных уровней возрастает, число электронов на внешнем слое не меняется и равно номеру группы, ради-ус атома увеличивается, восстановительные свойства увеличиваются, окислительные свойства уменьшаются, высшая степень окисления постоянна и равна номеру группы, низшая степень окисления не изменяется и равна (- №группы), металлические свойства веществ усиливаются, неметаллические свойства - ослабевают.. Общими для элементов главных и побочных подгрупп являются формулы высших оксидов (и их гидратов). У высших оксидов и их гидратов элементов I - III групп (кроме бора) преобладают основные свойства, с IV по VIII - кислотные. В каждой главной подгруппе ( кроме VIII) сверху вниз усиливается основной характер оксидов и гидроксидов, кислотные же свойства ослабевают.
Это связано с увеличением числа электронных слоёв, а следовательно с уменьшением сил притяжения электронов последнего слоя к ядру.
Кислотно-основные свойства оксидов и гидроксидов элементов
Задача 776.
Как изменяются кислотно-основные и окислительно-восстановительные свойства высших оксидов и гидроксидов элементов с ростом заряда их ядер: а) в пределах периода; б) в пределах группы?
Решение:
а) В пределах периода с ростом заряда ядер атомов элементов кислотно-основные свойства их высших оксидов изменяются следующим образом, уменьшается способность к образованию кислот. Изменение кислотно-основных свойств по периоду хорошо можно проследить на примере следующих соединений элементов третьего периода:
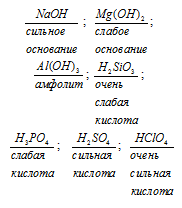
Окислительно-восстановительные свойства по периодам с ростом зарядов атомов элементов изменяются следующим образом, ослабевают восстановительные и усиливаются окислительные свойства элементов. Например, в третьем периоде восстановительная способность уменьшается в последовательности: Na2O, MgO, Al2O3, SiO2, P2O5, а окислитель-ная способность растёт в последовательности: NaOH, Mg(OH)2, Al(OH)3, H3PO4, H2SO4, HClO4. Кислотно-восстановительные свойства элементов зависят от числа проявленных ими степеней окисления. По периоду число проявленных элементами степеней окисленности закономерно возрастают: Na проявляет две степени окисленности (0 и +1), Cl – семь (0, -1, +1, +3, +4, +5, +6, +7).
б) В группах с ростом зарядов ядер атомов элементов кислотно-основные свойства оксидов и гидроксидов элементов изменяются следующим образом, усиливаются основные свойства и ослабевают кислотные. Например, в группах электроположительных элементов нарастает сила оснований: Ве(ОН)2 является амфотерным соединением, а Ва(ОН)2 - сильное основание. По группам с ростом зарядов атомов элементов восстановительная способность высших оксидов и гидроксидов элементов нарастает, а окислительная - уменьшается, например, у элементов VII-й группе (HClO4, HBrO4, HIO4) самый сильный восстановитель HClO4, а самый слабый - HIO4. Во II-й группе (ВеО, MgO, CaO, SrO, BaO) самым сильным восстановителем является ВаО, а самым слабым – ВеО.

