Строение атома водорода и его изотопов
Изотопы водорода
Задача 781.
Описать атомы протия, дейтерия и трития. В чем различие этих атомов? Какие изотопы водорода стабильны?
Решение:
Водород имеет три изотопа: протий (или Н), дейтерий (или D) и тритий (или Т). Массовые доли их соответственно равны 1, 2 и 3. Протий и дейтерий – стабильные изотопы водорода, тритий – радиоактивен (период полураспада 12,5 лет).
Ядро атома протия содержит один протон, а ядро дейтерия и протия включает, кроме протона, соответственно один и два нейтрона. Таким образом, атомы протия, дейтерия и трития содержат на энергетическом уровне по одному электрону, различаются только ядра изотопов: протий содержит только протон, дейтерий – протон и нейтрон, а тритий – протон и два нейтрона. Простое вещество водорода состоит из двухатомных молекул: Н2, D2, Т2.
Энергетическая схема образования молекулы
Задача 782.
Исходя из строения атома водорода: а) указать возможные валентные состояния и степени окисленности водорода; б) описать строение молекулы Н2 с позиций методов ВС и МО; в) обосновать невозможность образования молекулы Н3.
Решение:
а) Свойства водорода определяются способностью его атомов отдавать единственный электрон и превращаться в положительно заряжённый ион . При этом проявляется особенность атома водорода, отличающая его от атомов других элементов, отсутствие промежуточных электронов между валентным электроном и ядром. Ион водорода, образующийся в результате потери атомом водорода электрона, представляет собой протон, размеры которого меньше размера катионов всех других элементов на несколько порядков. Атом водорода способен не только отдавать, но и присоединять один электрон, до полного завершения s – подуровня. При этом образуется отрицательно заряжённый ион водорода с электронной оболочкой атома гелия (+11s2 ). Таким образом, степень окисления водорода может иметь значения -1, 0 +1.
б) Строение молекулы Н2 с позиций метода ВС можно представить так:
H. + .H ↔ H (:) H
Или
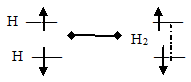
Энергетическая схема образования молекулы (Н2) по методу МО:
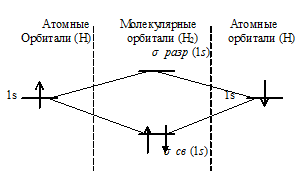
в) Энергетическая схема образования молекулы (Н3) по методу МО:
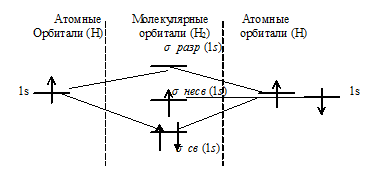
Как видно из диаграммы число связывающих электронов здесь равно 3. Порядок связи ( ) равен:
) равен:
n = (3 - 0)/2 = 1,5.
Следовательно, образование Н3 будет сопровождаться выделением энергии – молекула может существовать.
Водородная связь
Задача 783.
Почему между молекулами водорода и молекулами кислорода не образуются водородные связи?
Решение:
Атом водорода, соединённый с атомом сильно электроотрицательного элемента (О, F, N, и др.), способен к образованию ещё одной химической связи с другим подобным атомом. Эта связь намного слабее обычной ковалентной и называется водородной связью, обозначается тремя точками:
HF...HF.
Возникновение водородной связи можно объяснить действием электростатических сил. Так при образовании полярной ковалентной связи между атомом водорода и атомом фтора, который характеризуется высокой электроотрицательностью, электронное облако, первоначально принадлежащее атому водорода, сильно смещено в сторону атома фтора. В результате атом фтора приобретает значительный эффективный отрицательный заряд, а ядро водорода (протон) с внешней по отношению к атому фтора стороны почти лишается электронного облака. Между атомом водорода одной молекулы и отрицательно заряжённым атомом фтора соседней молекулы HF возникает электростатическое притяжение, что и приводит к образованию водородной связи. Процесс образования водородной связи между двумя молекулами HF может быть представлен схемой:
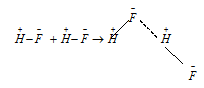
Молекулы Н2 и О2 – нейтральные частицы, образованные неполярными ковалентными связями, не являются диполями, поэтому при приближении их друг к другу сил электро-статического взаимодействия не наблюдается, никаких дополнительных химических связей не образуется, наоборот, при приближении их будут наблюдаться силы отталкивания.
Задача 784.
В виде, каких ионов может входить водород в состав химических соединений?
Решение:
Атом водорода имеет один электрон, который он может отдать, превратившись при этом в положительный ион – катион водорода Н+. При этом проявляется особенность атома водорода, отличающая его от атомов других элементов, отсутствие промежуточных электронов между валентным электроном и ядром атома. Ион водорода, образующийся в результате потери атомом единственного электрона, представляет собой, по сути, протон, размеры которого на несколько порядков меньше, чем размеры катионов других элементов. Поэтому поляризующее действие протона очень велико, вследствие чего водород не способен образовывать ионных соединений даже с наиболее активными неметаллами. Например, с фтором, водород образует вещество с полярной ковалентной связью. Атом водорода также способен присоединять один, недостающий до полного завершения электронного уровня, электрон. При этом образуется отрицательно заряжённый ион водорода H- с электронной конфигурацией атома гелия. В виде таких ионов водород образует ионные соединения с некоторыми металлами, например: NaH, CaH2.

