Определение направления самопроизвольного протекания реакций
Задача 672.
Указать, в каком направлении могут самопроизвольно протекать следующие реакции:
а) H2O2 + HOCl = HCl + O2 + H2O;
б) 2HIO3 + 5H2O2 = I2 + 5O2 + 6H2O;
в) I2 + 5H2O2 = 2HIO3 + 4H2O.
Решение:
а) H2O2 + HOCl = HCl + O2 + H2O
Составляем уравнения электронного баланса:
2О-1 - 2е = 2О0 Е1 = +0,68 В;
Cl+1 + 2e = Cl-1 E2 = +1,5 B.
Из уравнений реакций электронного баланса следует, что Е1 < E2, поэтому реакция самопроизвольно протекает слева направо, в сторону прямой реакции.
б) 2HIO3 + 5H2O2 = I2 + 5O2 + 6H2O
Составляем уравнения электронного баланса:
5|10|2О-1 - 2е = 2О0 Е1 = +0,68 В;
1| 2|2I+5 +10e = 2I0 E2 = +1,19 B.
Из уравнений реакций электронного баланса следует, что Е1 < E2, поэтому реакция самопроизвольно протекает слева направо, в сторону прямой реакции.
в) I2 + 5H2O2 = 2HIO3 + 4H2O
Составляем уравнения электронного баланса:
1| 2|2I0 -10e = 2I+5 E1 = +1,19 B;
5|10|2O-1 -2e = 2O-2 E2 = +1,77 B.
Из уравнений реакций электронного баланса следует, что Е1 < E2, поэтому реакция самопроизвольно протекает слева направо, в сторону прямой реакции.
Ответ: все реакции протекают в прямом направлении.
Задача 673.
Какие из приведенных ниже реакций могут протекать самопроизвольно?
а) H3PO4 + 2HI = H3PO3 + I2 + H2O;
б) H3PO3 + SnCl2 + H2O = 2HCl + Sn + H3PO4;
в) H3PO3 + 2AgNO3 + H2O = 2Ag + 2HNO3 + H3PO4;
г) H3PO3 + Pb(NO3)2 + H2O = Pb + 2HNO3 + H3PO4.
Решение:
а) H3PO4 + 2HI = H3PO3 + I2 + H2O
Составляем уравнения электронного баланса:
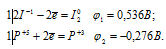
Из уравнений электронного баланса следует, что ![]() 1 >
1 >  2, поэтому процесс не может самопроизвольно протекать в стандартных условиях.
2, поэтому процесс не может самопроизвольно протекать в стандартных условиях.
б) H3PO3 + SnCl2 + H2O = 2HCl + Sn + H3PO4
Составляем уравнения электронного баланса:
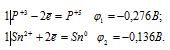
Из уравнений электронного баланса следует, что ![]() 1 <
1 <  2, поэтому процесс может само-произвольно протекать в стандартных условиях.
2, поэтому процесс может само-произвольно протекать в стандартных условиях.
в) H3PO3 + 2AgNO3 + H2O = 2Ag + 2HNO3 + H3PO4
Составляем уравнения электронного баланса:
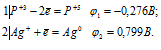
Из уравнений электронного баланса следует, что ![]() 1 <
1 <  2, поэтому процесс может самопроизвольно протекать в стандартных условиях.
2, поэтому процесс может самопроизвольно протекать в стандартных условиях.
г) H3PO3 + Pb(NO3)2 + H2O = Pb + 2HNO3 + H3PO4
Составляем уравнения электронного баланса:
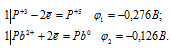
Из уравнений электронного баланса следует, что ![]() 1 <
1 <  2, поэтому процесс может самопроизвольно протекать в стандартных условиях.
2, поэтому процесс может самопроизвольно протекать в стандартных условиях.
Ответ: б); в); г).
Задача 674.
Можно ли в водном растворе восстановить соль железа(III) до соли железа (II): а) бромидом калия; 6) йодидом калия?
Решение:
а) Составляем уравнения электронного баланса:
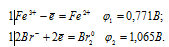
Из уравнений электронного баланса следует, что ![]() 1 <
1 <  2, поэтому процесс может самопроизвольно протекать в стандартных условиях.
2, поэтому процесс может самопроизвольно протекать в стандартных условиях.
б) Составляем уравнения электронного баланса:
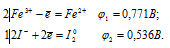
Из уравнений электронного баланса следует, что ![]() 1 >
1 >  2, поэтому процесс не может самопроизвольно протекать в стандартных условиях.
2, поэтому процесс не может самопроизвольно протекать в стандартных условиях.
Ответ: а).

