Соотношение стандартных изменений энтальпии и энтропии реакций
Задача 316.
Для следующих реакций:
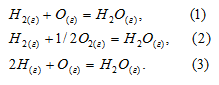
указать правильное соотношение стандартных изменений энтальпии:
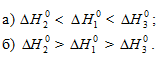
Решение:
По табличным данным стандартные энтальпии образования веществ, участвующих в реакциях равны (стандартные энтальпии простых веществ принято считать равными нулю):
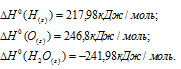
Для расчета  реакций используем уравнение из следствия закона Гесса:
реакций используем уравнение из следствия закона Гесса:
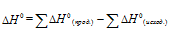
а) Находим стандартную энтальпию реакции:
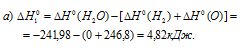
б) Находим стандартную энтальпию реакции:
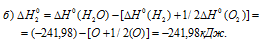
в) Находим стандартную энтальпию реакции:
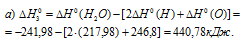
Таким образом,  2 и
2 и  1 <
1 <  3.
3.
Ответ: а).
Задача 317.
Указать, какие из нижеследующих утверждений правильны для реакций, протекающих в стандартных условиях: а) эндотермические реакции не могут протекать самопроизвольно; б) эндотермические реакции могут протекать при достаточно низких температурах; в) эндотермические реакции могут протекать при достаточно высоких температурах, если изменение энтропии реакции положительно.
Решение:
Эндотермическая реакция имеет значение энтальпии  H > 0. Если
H > 0. Если  H > 0,
H > 0,  > 0, то в уравнении
> 0, то в уравнении
 =
=  H - T
H - T второй член равенства (- T
второй член равенства (- T ) будет иметь отрицательное значение, поэтому член (
) будет иметь отрицательное значение, поэтому член ( ) примет тоже отрицательное значение только при достаточно большом числовом значении (Т).
) примет тоже отрицательное значение только при достаточно большом числовом значении (Т).
При  H > 0,
H > 0,  < 0 в уравнении (
< 0 в уравнении ( =
=  H - T
H - T ) второй член равенства (- T
) второй член равенства (- T ) будет иметь положительное значение, поэтому при любом значении температуры (Т) член (
) будет иметь положительное значение, поэтому при любом значении температуры (Т) член ( ) будет всегда иметь тоже положительное значение. Таким образом, при
) будет всегда иметь тоже положительное значение. Таким образом, при  H > 0,
H > 0,  < 0 реакция невозможна при любых значениях температуры; при
< 0 реакция невозможна при любых значениях температуры; при
 H > 0,
H > 0,  > 0 реакция возможна только при достаточно высоких температурах. Значит, эндотермические реакции могут протекать при достаточно высоких температурах, если изменение энтропии реакции имеет положительное значение.
> 0 реакция возможна только при достаточно высоких температурах. Значит, эндотермические реакции могут протекать при достаточно высоких температурах, если изменение энтропии реакции имеет положительное значение.
Ответ: в).
Задача 318.
Не производя вычислений, указать, для каких из перечисленных процессов изменение энтропии положительно:
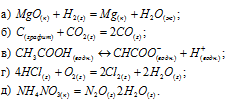
Решение:
а) В реакции не наблюдается изменения общего числа молей веществ, из одного кристаллического и одного газообразного веществ образуется одинаковое число кристаллического и жидкого веществ, это, естественно, приводит к упорядоченности системы, что сопровождается уменьшением энтропии,  < 0.
< 0.
б) В реакции не наблюдается изменения общего числа молей веществ, но число молей газообразных веществ возрастает вдвое, это, естественно, приводит к упорядоченности системы, что сопровождается уменьшением энтропии,  > 0.
> 0.
в) Реакция протекает без изменения агрегатных состояний веществ, но с увеличением молей продуктов реакции, это ведёт к уменьшению упорядоченности системы, значит  > 0.
> 0.
г) В реакции происходит уменьшение, как общего числа молей реагирующих веществ, так и общего числа молей газообразных веществ, это приводит систему в состояние большей упорядоченности, значит  < 0.
< 0.
д) В реакции происходит увеличение общего числа молей реагирующих веществ, и к тому же из кристаллического вещества образуются два газообразных веществ, это приводит к уменьшению упорядоченности системы, значит  > 0.
> 0.
Ответ: б), в), д).
Задача 319.
В каком из следующих случаев реакция возможна при любых температурах: а)  H < 0;
H < 0; > 0; 6)
> 0; 6)  H < 0,
H < 0,  < 0; в)
< 0; в)  H > 0,
H > 0, >0?
>0?
Решение:
а) При  H < 0,
H < 0,  > 0 в уравнении (
> 0 в уравнении ( =
=  H - T
H - T ) второй член равенства ( - T
) второй член равенства ( - T ) будет иметь отрицательное значение при любых значениях температуры (Т). Значит,
) будет иметь отрицательное значение при любых значениях температуры (Т). Значит,  при
при  H < 0,
H < 0, > 0 всегда имеет отрицательное значение, поэтому реакция возможна при любых температуре.
> 0 всегда имеет отрицательное значение, поэтому реакция возможна при любых температуре.
б) При  H < 0,
H < 0,  < 0 реакция возможна при условии, что
< 0 реакция возможна при условии, что  H в уравнении (
H в уравнении ( =
=  H - T
H - T ) больше по абсолютному значению, чем член (T
) больше по абсолютному значению, чем член (T ); поскольку абсолютное значение члена (T
); поскольку абсолютное значение члена (T ) с ростом множителя (Т) увеличивается, то указанное условие будет осуществляться при достаточно низких температурах, т.е. при низких температурах наиболее вероятно самопроизвольное протекание экзотермических реакций, даже если при этом энтропия системы уменьшается.
) с ростом множителя (Т) увеличивается, то указанное условие будет осуществляться при достаточно низких температурах, т.е. при низких температурах наиболее вероятно самопроизвольное протекание экзотермических реакций, даже если при этом энтропия системы уменьшается.
в) При  H > 0,
H > 0, > 0 в уравнении (
> 0 в уравнении ( =
=  H - T
H - T ) второй член равенства ( - T
) второй член равенства ( - T ) будет иметь отрицательное значение, поэтому член (
) будет иметь отрицательное значение, поэтому член ( ) примет тоже отрицательное значение только при достаточно большом числовом значении (Т). Член (
) примет тоже отрицательное значение только при достаточно большом числовом значении (Т). Член ( ) может быть отрицателен только при очень высоких значениях температуры (Т). Реакция возможна только при достаточно высоких температурах, потому что с ростом члена (Т) будет наблюдаться уменьшение значения члена (
) может быть отрицателен только при очень высоких значениях температуры (Т). Реакция возможна только при достаточно высоких температурах, потому что с ростом члена (Т) будет наблюдаться уменьшение значения члена ( ).
).
Ответ: а).

