Расчеты константы и изменения скорости реакции
Задача 325.
Найти значение константы скорости реакции А + В ⇒ АВ, если при концентрациях веществ А и В, равных соответственно 0,05 и 0,01 моль/л, скорость реакции равна 5 . 10-5 моль/(л. мин).
Решение:
Скорость химической реакции выражается уравнением:
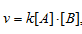
v- скорость реакции, k - константа скорости реакции, [A] и [B] – концентрации исходных веществ.
Тогда
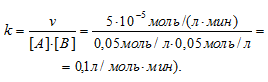
Ответ: 0,1/моль . мин.
Задача 326.
Во сколько раз изменится скорость реакции 2А + В ⇒ А2В, если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в 2 раза?
Решение:
До изменения концентрации скорость реакции можно выразить уравнением:
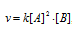
v- скорость реакции, k - константа скорости реакции, [A] и [B] – концентрации исходных веществ.
Вследствие увеличения концентрации вещества А в 2 раза и уменьшения концентрации вещества В в 2 раза скорость реакции будет выражаться уравнением:
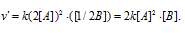
Сравнивая выражения для v и v' , находим, что скорость реакции увеличилась в 2 раза.
Ответ: увеличилась в 2 раза.
Задача 327.
Во сколько раз следует увеличить концентрацию вещества В2 в системе
2А2(г) + В2(г) = 2А2В, чтобы при уменьшении концентрации вещества А в 4 раза скорость прямой реакции не изменилась?
Решение:
Концентрацию вещества А уменьшили в 4 раза. Изменение концентрации вещества В обозначим через x. Тогда до изменения концентрации вещества А скорость реакции можно выразить уравнением:
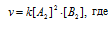
v- скорость реакции, k - константа скорости реакции, [A] и [B] – концентрации исходных веществ.
После изменения концентрации вещества А2 скорость реакции будет выражаться уравнением:
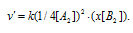
По условию задачи v = v' или
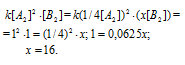
Таким образом, следует увеличить в 16 раз концентрацию вещества В2 в системе 2А2(г) + В2(г) = 2А2В, чтобы при уменьшении концентрации вещества А2 в 4 раза скорость прямой реакции не изменилась.
Ответ: в 16 раз.
Задача 328.
В два сосуда одной и той же вместимости введены: в первый - 1 моль газа А и 2 моля газа В, во второй 2 моля газа А и 1 моль газа В. Температура в обоих сосудах одинакова. Будет ли различаться скорость реакции между газами А и В в этих сосудах, если скорость реакции выражается: а) уравнением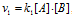 б) уравнением
б) уравнением 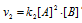
Решение:
а) Если скорость реакции выражается уравнением 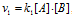 , то, учитывая концентрации веществ А и В в сосудах, запишем выражения скоростей реакции для сосудов:
, то, учитывая концентрации веществ А и В в сосудах, запишем выражения скоростей реакции для сосудов:
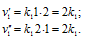
Таким образом, 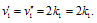
б) Если скорость реакции выражается уравнением 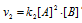 , то, учитывая концентрации веществ А и В в сосудах, запишем выражения скоростей реакции для сосудов:
, то, учитывая концентрации веществ А и В в сосудах, запишем выражения скоростей реакции для сосудов:
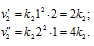
Таким образом, 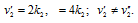
Ответ: а) нет, б) да.
Задача 329.
Через некоторое время после начала реакции 3А + В ⇒ 2С + D концентрации веществ составляли: [А] = 0,03 моль/л; [В] =0,01 моль/л; [С] = 0,008 моль/л. Каковы исходные концентрации веществ А и В?
Решение:
Для нахождения концентраций веществ А и В учтём, что, согласно уравнению реакции, из 3 молей вещества А и 1 моля вещества В образуется 1 моль вещества С. Поскольку по условию задачи в каждом литре системы образовалось 0,008 молей вещества С, то при этом было израсходовано 0,012 моля вещества А (3/2 . 0,008 = 0.012) и 0,004 моля вещества В (1/2 . 0,008 = 0,004). Таким образом исходные концентрации веществ А и В будут равны:
[A]0 = 0,03 + 0,012 = 0,042 моль/л;
[B]0 = 0,01 + 0,004 = 0,014 моль/л.
Ответ: [A]0 = 0,042 моль/л; [B]0 = 0,014 моль/л.
Задача 330.
В системе СО + С12 = СОС12 концентрацию увеличили от 0,03 до 0,12 моль/л, а концентрацию хлора от 0,02 до 0,06 моль/л. Во сколько раз возросла скорость прямой реакции?
Решение:
До изменения концентрации скорость реакции можно выразить уравнением:
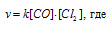
v- скорость реакции, k - константа скорости реакции, [СО] и [Cl2] – концентрации исходных веществ.
Тогда
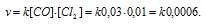
После увеличения концентрации реагирующих веществ скорость реакции равна:
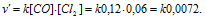
Рассчитаем, во сколько раз возросла скорость реакции:
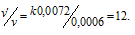
Ответ: в 12 раз.

