Факторы, вызывающие изменения значений константы равновесия реакции
Задача 378.
При 20 °С константа скорости некоторой реакции равна 104 мин-1, а при 50°С – 8 . 104 мин-1. Чему равен температурный коэффициент скорости реакции: а) 2; б) 3; в) 4?
Решение:
Зависимость скорости реакции (или константы скорости реакции) от температуры может быть выражена уравнением:
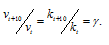
Здесь vt и kt - скорость и константа скорости реакции при температуре t°С; v(t + 10) и k(t + 10) те же величины при температуре (t + 100C); 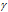 - температурный коэффициент скорости реакции, значение которого для большинства реакций лежит в пределах 2 - 4 (правило Вант-Гоффа). В общем случае, если температура изменилась на °С, последнее уравнение преобразуется к виду:
- температурный коэффициент скорости реакции, значение которого для большинства реакций лежит в пределах 2 - 4 (правило Вант-Гоффа). В общем случае, если температура изменилась на °С, последнее уравнение преобразуется к виду:
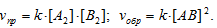
Поскольку по условию задачи равно 300С (50 – 20 = 30), то подставив данные задачи, находим значение температурного коэффициента:
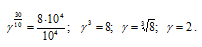
Ответ: а).
Задача 379.
Скорость, каких реакций увеличивается с ростом температуры: а) любых; б) протекающих с выделением энергии; в) протекающих с поглощением энергии?
Решение:
При увеличении температуры возрастает кинетическая энергия движения молекул и число столкновений их друг с другом, поэтому при повышении температуры скорость реакции возрастает.
Зависимость скорости реакции (или константы скорости реакции) от температуры может быть выражена уравнением:
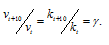
Здесь vt и kt - скорость и константа скорости реакции при температуре t°С; vt + 10 и kt + 10 те же величины при температуре (t + 100C); 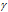 - температурный коэффициент скорости реакции, значение которого для большинства реакций лежит в пределах 2 - 4 (правило Вант-Гоффа). В общем случае, если температура изменилась на °С, последнее уравнение преобразуется к виду:
- температурный коэффициент скорости реакции, значение которого для большинства реакций лежит в пределах 2 - 4 (правило Вант-Гоффа). В общем случае, если температура изменилась на °С, последнее уравнение преобразуется к виду:
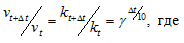
Более точно зависимость скорости (или константы) реакции от температуры определяется уравнением Аррениуса:
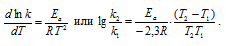
Из этого уравнения вытекает, что константа скорости реакции возрастает при повышении температуры Т.
Таким образом, при повышении температуры возрастает скорость (или константа скорости) химической реакции, главным образом за счёт роста числа активных молекул в реакционной среде.
Ответ: а).
Задача 380.
Если константа скорости одной реакции (k') больше константы скорости второй реакции (k"), то какое соотношение между энергиями активации этих реакций правильно: а) Ea' > Ea"; б) Ea' < Ea"; в) нельзя определить?
Решение:
Зависимость константы скорости реакции (k) от энергии активации (Ea) выражается уравнением Аррениуса:
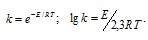
Из уравнения следует, что величина константы скорости реакции зависит от температуры и энергии активации реакции, причём, чем меньше энергия активации, тем выше значение константы реакции.
Если k' > k", то можно записать
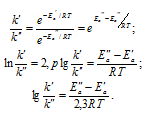
Таким образом, при k' > k"; Ea" > Ea', т.е. Ea' < Ea".
Ответ: б).
Задача 381.
Какие из перечисленных воздействий приведут к изменению значения константы равновесия химических реакций: а) изменение давления; б) изменение температуры; в) замена катализатора; г) изменение концентраций реагирующих веществ?
Решение:
а) При изменении давления в реакционной системе будет изменяться концентрация веществ находящихся в жидком или в газообразном состоянии. Изменение концентрации реагирующих веществ приведёт к смещению равновесия системы вправо или влево. При этом скорости как прямой, так и обратной реакций не изменятся, т.е. константа равновесия данной реакции тоже не изменится, будет иметь прежнее значение.
б) Зависимость константы уравнения реакции выражается уравнением:
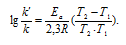
Отсюда вытекает, что при изменении температуры реакционной системы изменится значение константы равновесия.
в) Замена катализатора способствует изменению скорости как прямой, так и обратной реакции, потому что катализаторы – вещества, которые увеличивают скорости как прямой, так и обратной реакции, поэтому константа равновесия реакции не изменится.
г) Константу равновесия реакции A + B ⇔ C + D можно описать, согласно закону действия масс, выражением:
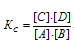
Кс – константа равновесия, [C], {D], [A] и [B] - концентрации равновесия реагирующих веществ.
Из этого выражения следует, что при изменении концентраций реагирующих веществ изменяются лишь направление смещения системы, а константа равновесия не меняется.
Таким образом, значение константы равновесия реакции изменяется только при изменении температуры.
Ответ: б).
Задача 382.
Если объем закрытого реакционного сосуда, в котором установилось равновесие 2SO2(г) + O2(г) ⇔ 2SO3(г), уменьшить в 2 раза, то: а) скорости прямой и обратной реакций останутся одинаковыми; б) скорость прямой реакции станет в 2 раза больше скорости обратной реакции; в) равновесие не сместится; г) равновесие сместится вправо; д) равновесие сместится влево?
Решение:
Уравнение реакции имеет вид:
2SO2(г) + O2(г) ⇔ 2SO3(г)
Если объём системы при установившемся равновесии уменьшить в 2 раза, то, соответственно, в 2 раза увеличится концентрации газообразных веществ. Скорости прямой и обратной реакций, соответственно изменятся. Запишем выражения закона действующих масс для прямой и обратной скоростей реакций:
vпр = k[SO2]2 . [O2]; Vобр = [SO3]2.
Подставив, полученные изменения значений концентраций реагирующих веществ в выражения закона действующих масс реакций данной системы, получим:
v'пр = k . (2[SO2])2 . 2[O2] =
= k . 22 .2 = 8k;
V'обр = k . (2[SO3])2 = k . 22 = 4k.
Находим во сколько раз скорость прямой реакции больше, чем обратной:
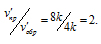
Таким образом, скорость прямой реакции в 2 раза стала больше, чем обратной.
Из уравнения реакции следует, что данная реакция протекает с уменьшением, как числа молей реагирующих веществ, так и с уменьшением числа молей газообразных веществ, поэтому, согласно принципу Ле Шателье, при уменьшении объёма системы равновесие сместится в вправо, в сторону уменьшения числа молей газообразных веществ.
Ответ: б); г).

