Рассчеты с применением константы равновесия реакции
Задача 388.
С ростом температуры значение константы равновесия реакции
2Н2О(г) ⇔ 2Н2(г) + О2(г) возрастает. Каков знак  этой реакции:
этой реакции:
а)  > 0; б)
> 0; б)  < 0; в) по данным задачи нельзя определить?
< 0; в) по данным задачи нельзя определить?
Решение:
Из уравнения 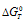 = 2,3RTlgKT следует, что с ростом температуры (Т) и ростом значения константы равновесия реакции (КТ), уменьшается значение
= 2,3RTlgKT следует, что с ростом температуры (Т) и ростом значения константы равновесия реакции (КТ), уменьшается значение  .
.
Согласно принципу Ле Шателье, при повышении температуры системы равновесие смещается в сторону эндотермической реакции. Эндотермическая реакция протекает с поглощением теплоты, т.е. энтальпия данной реакции больше нуля,  > 0. К тому же из уравнения 2Н2О(г) ⇔ 2Н2(г) + О2(г) следует, что данная реакция протекает с увеличением как общего числа молекул продуктов реакции, так и увеличением числа молекул газообразных продуктов реакции, т.е. система из более устойчивого состояния переходит в менее устойчивое состояние, значит,
> 0. К тому же из уравнения 2Н2О(г) ⇔ 2Н2(г) + О2(г) следует, что данная реакция протекает с увеличением как общего числа молекул продуктов реакции, так и увеличением числа молекул газообразных продуктов реакции, т.е. система из более устойчивого состояния переходит в менее устойчивое состояние, значит, > 0. При
> 0. При  > 0 и ,
> 0 и , > 0 процесс может протекать только при достаточно высоких температурах, как вытекает из уравнения энергии Гиббса, что и соответствует условию задачи.
> 0 процесс может протекать только при достаточно высоких температурах, как вытекает из уравнения энергии Гиббса, что и соответствует условию задачи.
Ответ: а).
Задача 389.
Для некоторой реакции  > 0. Какие из приведенных утверждений правильны: а) К > 1; б) К < 1; в) в равновесной смеси преобладают продукты реакции; г) в равновесной смеси преобладают исходные вещества?
> 0. Какие из приведенных утверждений правильны: а) К > 1; б) К < 1; в) в равновесной смеси преобладают продукты реакции; г) в равновесной смеси преобладают исходные вещества?
Решение:
Константа равновесия химической реакции (KT) связана со стандартным значением энергии Гиббса реакции ( )
)
уравнением 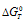 = 2,3RTlgKT.
= 2,3RTlgKT.
Положительный знак члена ( ) возможен только тогда когда член (lgK), т.е. K < 0. Это означает, что при положительном значении
) возможен только тогда когда член (lgK), т.е. K < 0. Это означает, что при положительном значении  равновесие системы смещено в сторону обратной реакции и в равновесной смеси преобладают исходные вещества.
равновесие системы смещено в сторону обратной реакции и в равновесной смеси преобладают исходные вещества.
Ответ: б); г).
Задача 390.
Константа равновесия некоторой реакции при 293 К равна 5 . 10-3, а при 1000 К составляет 2 . 10-6. Каков знак  этой реакции: а)
этой реакции: а)  > 0; 6)
> 0; 6)  < 0?
< 0?
Решение:
Зависимость константы равновесия (KT) химической реакции связана со стандартным значением энергии Гиббса данной реакции (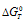 ) уравнением:
) уравнением: 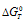 = 2,3RTlgKT
= 2,3RTlgKT
Как показывает данное выражение отрицательное значение константы равновесия (KT), К < 1, возможно при положительном значении члена (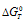 ). Положительное значение
). Положительное значение 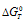 означает, что равновесие реакции смещено в направлении обратной реакции. Согласно принципу Ле Шателье следует, что повышение температуры приводит к смещению равновесия системы в направлении реакции сопровождающейся поглощением теплоты,
означает, что равновесие реакции смещено в направлении обратной реакции. Согласно принципу Ле Шателье следует, что повышение температуры приводит к смещению равновесия системы в направлении реакции сопровождающейся поглощением теплоты,  > 0.
> 0.
Таким образом, прямая реакция является экзотермической, т.е.  < 0.
< 0.
Ответ: б).

