Вычисление константы равновесия системы
Константа равновесия для гомогенной реакции
Задание 135.
Вычислите константу равновесия для гомогенной системы:
СО (г) + Н2О (г) ↔ СО2 (г) + Н2 (г), если равновесные концентрации реагирующих веществ (молы/л):
[СО]р = 0,004; [Н2О]р = 0,064; [СО2]р = 0,016; [Н2]р = 0,016. Чему равны исходные концентрации воды и СО? Ответ: Кр = 1; [H2O]исх = 0,08 моль/л; [СО]исх = 0, 02 моль/л.
Решение:
Уравнение реакции имеет вид:
СО (г) + Н2О (г) ⇔ СО2 (г) + Н2 (г)
Константа уравнения данной реакции имеет выражение:
Kp = [CO2].[H2]/ [CO].[H2O]
Подставляя в выражение данные задачи получим:
Кр = (0,016 . 0,016)/(0,004 . 0,064) = 1.
Для нахождения исходных концентраций веществ Н2О и СО учтём, что согласно уравнению реакции из 1 моль СО и 1 моль Н2О образуется 1 моль СО2 и 1 моль Н2. Поскольку по условию задачи в каждом литре системы образовалось 0,016 моль СО2 и 0,016 моль Н2, то при этом было израсходовано по 0,016 моль СО и Н2О. Таким образом, искомые исходные концентрации равны:
[H2O]исх = [Н2О]Р + 0,016 =
= 0,004 + 0,016 = 0,02 моль/л;
[СО]исх = [СО]Р + 0,016 =
= 0,064 + 0,016 = 0, 08 моль/л.
Ответ: Кp = 1; [H2O]исх = 0,08 моль/л; [СО]исх =0, 02 моль/л.
Задание 136.
Константа равновесия гомогенной системы:
СО (г) + Н2О (г) ⇔ СО2 (г) + Н2 (г) при некоторой температуре равна 1,00. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации равны (молы/л): [СО]исх = 0,10; [Н2О]исх = 0,40. Ответ: [СО2]Р = [Н2]Р = 0,08; [СO]P = 0,02; [Н2O]P = 0,32.
Решение:
Уравнение реакции имеет вид:
СО (г) + Н2О (г) ↔ СО2 (г) + Н2 (г)
При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы:
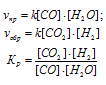
Обозначаем за "х" моль/л равновесную концентрацию одного из продуктов реакции, тогда равновесная концентрация другого будет также х моль/л так как они оба образуются в одинаковом количестве. Равновесные концентрации исходных веществ будут:
[СО]исх = 0,10 – х моль/л;
[Н2О]исх = 0,40 - х моль/л.
(так как на образование х моль/л продукта реакции расходуется соответственно по х моль/л СО и Н2О. В момент равновесия концентрация всех веществ будет (моль/л):
[СО2]Р = [Н2]Р = х;
[СO]P= 0,10 - х; [Н2O]P = 0,4 – х.
Подставляем эти значения в выражение константы равновесия:
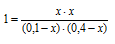
Решая уравнение, находим х = 0,08. Отсюда равновесные концентрации (моль/л):
[СО2]Р = [Н2]Р = х = 0,08 моль/л;
[Н2O]P = 0,4 – х = 0,4 – 0.08 = 0,32 моль/л;
[СO]P= 0,10 – х = 0,10 – 0,08 = 0,02 моль/л.
Задание 137.
Константа равновесия гомогенной системы N2 + ЗН2 = 2NH3 при некоторой температуре равна 0,1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 и 0,08 моль/л. Вычислите равновесную и исходную концентрации азота. Ответ: [N2]P = 8 молы/л; [N2]исх = 8,04 моль/л.
Решение:
Уравнение реакции имеет вид:
N2 + ЗН2 ↔ 2NH3
Обозначим равновесную концентрацию N2 через х моль/л. Выражение константы равновесия данной реакции имеет вид:
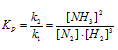
Подставим в выражение константы равновесия данные задачи и найдём концентрацию N2
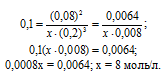
Для нахождения исходной концентрации N2, учтём, что, согласно уравнению реакции на образование 1 моль NH3 затрачивается ½ моль N2. Поскольку по условию задачи в каждом литре системы образовалось 0,08 моль NH3, то при этом было израсходовано 0,08 . 1/2 = 0,04 моль N2. Таким образом, искомая исходная концентрация N2 равна:
[N2]исх = [N2]P + 0,04 =
= 8 + 0,04 = 8,04 моль/л.
Ответ: [N2]P = 8 молы/л; [N2]исх = 8,04 моль/л.
Задание 138.
При некоторой температуре равновесие гомогенной системы:
2NО + O2 ↔ 2NO2 установилось при следующих концентрациях реагирующих веществ (молы/л):
[NО]p = 0,2; [О2]р = 0,1; [NO2]р = 0,1. Вычислите константу равновесия и исходную концентрацию NO и O2. Ответ: К = 2,5; [NО]исх = 0,3 молы/л; [О2]исх = 0,15 моль/л.
Решение:
Уравнение реакции:
2NО + O2 ↔ 2NO2
Константа равновесия данной реакции выражается уравнением:
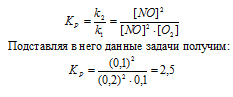
Для нахождения исходных концентраций NO и O2 учтём, что согласно уравнению реакции, из 2 моль NO и 1 моль О2 образуется 2 моль NO2, то при этом было затрачено 0,1 моль NO и 0,05 моль О2. Таким образом, исходные концентрации NO и О2 равны:
[NО]исх = NО]p + 0,1 = 0,2 + 0,1 = 0,3 молы/л;
[О2]исх = [О2]р + 0,05 = 0,1 + 0,05 = 0,15 моль/л.
Ответ: Кp = 2,5; [NО]исх = 0,3 молы/л; [О2]исх = 0,15 моль/л.
Смещение равновесия химической системы
Задание 139.
Почему при изменении давления смещается равновесие системы:
N2 + 3Н2 ↔ 2NH3 и, не смещается равновесие системы: N2 + O2 ↔ 2NO? Ответ мотивируйте на основании расчета скорости прямой и обратной реакций в этих системах до и после изменения давления. Напишите выражения для констант равновесия каждой из данных систем.
Решение:
а) Уравнение реакции:
N2 + 3Н2 ↔ 2NH3.
Из уравнения реакции следует, что реакция протекает с уменьшением объёма в системе (из 4 моль газообразных веществ образуется 2 моль газообразного вещества). Поэтому при изменении давления в системе будут наблюдаться смещение равновесия. Если повысить давление в данной системе, то, согласно принципу Ле Шателье, равновесие сместится вправо, в сторону уменьшения объёма. При смещении равновесия в системе вправо скорость прямой реакции будет больше скорости обратной реакции:
 пр >
пр > обр или
обр или  пр =
пр =
= k[N2] [H2]3 >  обр = k[NH3]2.
обр = k[NH3]2.
Если же давление в системе уменьшить, то равновесие системы сместится влево, в сторону увеличения объёма, то при смещении равновесия влево скорость прямой реакции будет меньше, чем скорость прямой:
 пр <
пр < ![]() обр или (
обр или ( пр =
пр =
= k[N2] [H2]3 ) < ( обр = k[NH3]2).
обр = k[NH3]2).
б) Уравнение реакции:
N2 + O2 ↔ 2NO.
Из уравнения реакции следует, что при протекании реакции не сопровождается изменением объёма, реакция протекает без изменения числа молей газообразных веществ. Поэ му изменение давления в системе не приведёт к смещению равновесия, поэтому скорости прямой и обратной реакции будут равны:
 пр =
пр = обр
обр
или
 пр k[N2] . [О2] =
пр k[N2] . [О2] =  обр = k[NО]2.
обр = k[NО]2.
Задание 140.
Исходные концентрации [NО]исх и [С12]исх в гомогенной системе
2NO + Сl2 ↔ 2NOС1 составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% NО. Ответ: 0,417.
Решение:
Уравнение реакции имеет вид: 2NO + Сl2 ↔ 2NOС1.
Согласно условию задачи в реакцию вступило 20% NO, что составляет 0,5 . 0,2 = 0,1 моль, а не прореагировало 0,5 – 0,1 = 0,4 моль NO. Из уравнения реакции следует, что на каждые 2 моль NO расходуется 1 моль Cl2, при этом образуется 2 моль NOCl. Следовательно, c 0,1 моль NO в реакцию вступило 0,05 моль Cl2 и образовалось 0,1 моль NOCl. Осталось не израсходованным 0,15 моль Cl2 (0,2 – 0,05 = 0,15). Таким образом, равновесные концентрации, участвующих веществ равны (моль/л):
[NО]р = 0,4; [Cl2]p = 0,15; [NОCl]р = 0,1.
Константа равновесия данной реакции выражается уравнением:
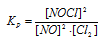
Подставляя в данное выражение равновесные концентрации веществ, получим:
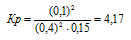
Ответ: Кр = 4,17.

