Вычисление энергии Гиббса и энтропии химической реакции
Энергия Гиббса
Задание 108.
Исходя из значений стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ, Вычислите  реакции, протекающей по уравнению:
реакции, протекающей по уравнению:
NH3 (г) + НСI (г) = NH4С1 (к).
Может ли эта реакция при стандартных условиях идти самопроизвольно?
Ответ: -92,08 кДж.
Решение:
Уравнение процесса имеет вид: NH3 (г) + НСl (г) = NH4Сl (к), 
Значения  и
и  находим из соотношений:
находим из соотношений:
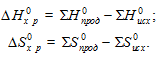
Значения 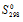 и
и  находим из специальных таблиц, получим:
находим из специальных таблиц, получим:
 =
=  (NH4Cl) –
(NH4Cl) – (NH3) +
(NH3) +  (HCl);
(HCl);
 = -315.39 - [-46,19 + (-92,31)] = -176,89 кДж;
= -315.39 - [-46,19 + (-92,31)] = -176,89 кДж;
 = S°(NH4Cl) – [ S°(NH3) + S°(HCl)];
= S°(NH4Cl) – [ S°(NH3) + S°(HCl)];
 = 94,5 – (192,5 + 186,68) = -284,68 Дж/моль . К.
= 94,5 – (192,5 + 186,68) = -284,68 Дж/моль . К.
Энергию Гиббса при соответствующих температурах находим из соотношения:
 =
=  - Т
- Т ;
;
 = -176,89 – 298(-0,28468) = -92,08 кДж.
= -176,89 – 298(-0,28468) = -92,08 кДж.
То, что < 0, указывает на возможность протекания прямой реакции при Т = 298 К и давлении взятых газов равном 1,01325 Па (760 мм. рт. ст. = 1 атм).
< 0, указывает на возможность протекания прямой реакции при Т = 298 К и давлении взятых газов равном 1,01325 Па (760 мм. рт. ст. = 1 атм).
Ответ: -92,08 кДж.
Равновесие системы
Задание 109.
При какой температуре наступит равновесие системы:
СО (г) + 2Н2 (г) = СН3ОН (ж);  = -128,05 кДж?
= -128,05 кДж?
Ответ: 385,5 К.
Решение:
Уравнение процесса имеет вид:
СО (г) + 2Н2 (г) = СН3ОН (ж); = -128,05 кДж.
= -128,05 кДж.
Значение  находим из соотношения:
находим из соотношения:
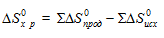
Значения 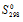 находим из специальных таблиц, получим:
находим из специальных таблиц, получим:
 = S°(СН3ОН) – [S°(СО) + 2S°(H2)];
= S°(СН3ОН) – [S°(СО) + 2S°(H2)];
 = 126,8 – 197,91 + (2 . 130,59) =
= 126,8 – 197,91 + (2 . 130,59) =
= -332,29 Дж/моль . К.
Энергию Гиббса при соответствующих температурах находим из соотношения:
![]() =
=  - Т
- Т ;
;
![]() = -128,05 – 298(-0,33229) = -290,03 кДж.
= -128,05 – 298(-0,33229) = -290,03 кДж.
То, что  < 0, указывает на возможность протекания прямой реакции при Т = 298 К и давлении взятых газов равном 1,01325 Па (760 мм. рт. ст. = 1 атм). Найдём температуру, при которой
< 0, указывает на возможность протекания прямой реакции при Т = 298 К и давлении взятых газов равном 1,01325 Па (760 мм. рт. ст. = 1 атм). Найдём температуру, при которой  = 0:
= 0:
![]() =
=  - Т
- Т ;
;
0 =  - Т
- Т ;
;
 = Т/
= Т/ ;
;
Т =  /
/ = -128,05/0,33229 = 385,5 К.
= -128,05/0,33229 = 385,5 К.
Следовательно, при температуре 385,5 K начнется реакция взаимодействия монооксида углерода с водородом. Иногда эту температуру называют температурой начала реакции.
Ответ: 385,5 К.
Задание 110.
При какой температуре наступит равновесие системы
СН4 (г) + СО2 (г) =2СО (г) + 2Н2 (г);  = +247,37 кДж.
= +247,37 кДж.
Ответ: 961,9 К.
Решение:
Уравнение процесса имеет вид:
СН4 (г) + СО2 (г) = 2СО (г) + 2Н2 (г);  = +247,37 кДж.
= +247,37 кДж.
Значение  находим из соотношения:
находим из соотношения:
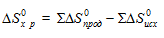
Значения 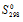 находим из специальных таблиц, получим:
находим из специальных таблиц, получим:
 = [2S°(СО) + 2S°(Н2)] – [S°(CH4)] + S°(СО)];
= [2S°(СО) + 2S°(Н2)] – [S°(CH4)] + S°(СО)];
 = (2 . 197,91) + 2(130,59) – (186,19 + 213,65) =
= (2 . 197,91) + 2(130,59) – (186,19 + 213,65) =
= +257,16 Дж/моль . К.
Найдём температуру, при которой  = 0:
= 0:
0 =  - Т
- Т ;
;
 = Т/
= Т/ ;
;
Т =  /
/ = -247,37/0,25716 = 961,9 К.
= -247,37/0,25716 = 961,9 К.
Следовательно, при температуре 961,9 K начнется реакция взаимодействия диоксида углерода с метаном. Иногда эту температуру называют температурой начала реакции.
Ответ: 961,9 К.
Вычисление энергии Гиббса
Задание 111.
На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите  реакции, протекающей по уравнению:
реакции, протекающей по уравнению:
4NH3 (г) + 5O2 (г) = 4NO (г) + 6H2O (г).
Возможна ли эта реакция при стандартных условиях? Ответ: -957,77 кДж.
Решение
Уравнение процесса:
4NH3 (г) + 5O2 (г) = 4NO (г) + 6H2O (г)
 =
=  - Т
- Т ;
;  и
и  - функции состояния системы, поэтому
- функции состояния системы, поэтому
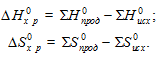
 = 4
= 4 (NО) + 6
(NО) + 6 (Н2О) – [4
(Н2О) – [4 (NH3) + 5
(NH3) + 5 (О2)];
(О2)];
 = 4(90,37) + 6(-241,83)] – [4(-46,19) = -904,74 кДж;
= 4(90,37) + 6(-241,83)] – [4(-46,19) = -904,74 кДж;
 = 4S0 (NO) + 6S0 (H2O) – [4S0(NH3) + 5S0 (O2)];
= 4S0 (NO) + 6S0 (H2O) – [4S0(NH3) + 5S0 (O2)];
 = 4(210,2) + 6(188,72) – [4(192,5)+ 5(205,03)] =
= 4(210,2) + 6(188,72) – [4(192,5)+ 5(205,03)] =
= +177,97 Дж/моль . К.
Энергию Гиббса при соответствующих температурах находим из соотношения:
![]() =
=  - Т
- Т ;
;
 = -904,74 – 298(-0,17797) = -957,78 кДж.
= -904,74 – 298(-0,17797) = -957,78 кДж.
То, что < 0, указывает на возможность протекания прямой реакции при Т = 298 К и давлении взятых газов равном 1,01325 Па (760 мм. рт. ст. = 1 атм).
< 0, указывает на возможность протекания прямой реакции при Т = 298 К и давлении взятых газов равном 1,01325 Па (760 мм. рт. ст. = 1 атм).
Ответ: -957,77 кДж.
На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите
 реакции, протекающей по уравнению:
реакции, протекающей по уравнению:СО2 (г) + 4Н2 (г) = СН4 (г) + 2Н2О (ж).
Возможна ли эта реакция при стандартных условиях? Ответ: -130,89 кДж.
Решение:
Уравнение процесса:
СО2 (г) + 4Н2 (г) = СН4 (г) + 2Н2О (ж).
 =
=  - Т
- Т ;
;  и
и  - функции состояния, поэтому
- функции состояния, поэтому
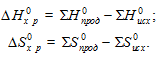
 =
=  (СН4) + 2
(СН4) + 2 (Н2О) –
(Н2О) –  (СО2)];
(СО2)];
 = -74,82 + 2(-285,84) – (-393,51) = -253,02 кДж;
= -74,82 + 2(-285,84) – (-393,51) = -253,02 кДж;
 = S°(СН4) + 2S°(H2O) – [S°(СО2) + 4S°(Н2)];
= S°(СН4) + 2S°(H2O) – [S°(СО2) + 4S°(Н2)];
 = 186,19 + 2(69,94) – [213,65 + 4(130,59)] =
= 186,19 + 2(69,94) – [213,65 + 4(130,59)] =
= -409,94 Дж/моль . K
Энергию Гиббсапри соответствующих температурах находим из соотношения:
![]() =
=  - Т
- Т ;
;
![]() = -252,02 – 298(-0,40994) = -130,89 кДж.
= -252,02 – 298(-0,40994) = -130,89 кДж.
То, что  < 0, указывает на возможность протекания прямой реакции при Т = 298 К и давлении взятых газов равном 1,01325 Па (760 мм. рт. ст. = 1 атм).
< 0, указывает на возможность протекания прямой реакции при Т = 298 К и давлении взятых газов равном 1,01325 Па (760 мм. рт. ст. = 1 атм).
Ответ: -130,89 кДж.
Задание: 113.
Вычислите  ,
,  и
и  реакции, протекающей по уравнению:
реакции, протекающей по уравнению:
Ее2О3 (к) + 3Н2 (г) = 2Ее (к) + 3Н2О (г).
Возможна ли реакция восстановления Ее2О3 водородом при 500 и 2000 К? Ответ: +96,61 кДж; 138,83 Дж/моль . К; 27,2 кДж; -181,05 кДж.
Решение:
Уравнение реакции имеет вид:
Ее2О3 (к) + 3Н2 (г) = 2Ее (к) + 3Н2О (г).
Значения  и
и  находим из соотношений:
находим из соотношений:
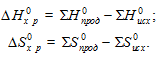
Значения  и
и  находим из соотношений:
находим из соотношений:
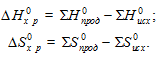
Значения 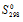 и
и  находим из специальных таблиц, получим:
находим из специальных таблиц, получим:
 = 3
= 3 (Н2О) – (
(Н2О) – ( (Ее2О3);
(Ее2О3);
 = 3(-241,83) - (-822,1)] = 96,61 кДж;
= 3(-241,83) - (-822,1)] = 96,61 кДж;
 = 3S°(Н2О) + 2S°(Fe) – [S°(Ее2О3) + 3S°(H2)];
= 3S°(Н2О) + 2S°(Fe) – [S°(Ее2О3) + 3S°(H2)];
 = 3(188,72) + 2(27,2) – [89,96 + 3(130,59) =
= 3(188,72) + 2(27,2) – [89,96 + 3(130,59) =
= -138,83 Дж/моль . К.
Энергию Гиббса при соответствующих температурах находим из соотношения:
 =
=  - Т
- Т ;
;
 = -96,61 – 500(-0,13883) = +27,2 кДж;
= -96,61 – 500(-0,13883) = +27,2 кДж;
То, что  > 0, указывает на невозможность протекания прямой реакции при Т = 298 К и давлении взятых газов равном 1,01325 Па (760 мм. рт. ст. = 1 атм), т. е. при температуре 500 К восстановление Ее2О3 водородом не протекает.
> 0, указывает на невозможность протекания прямой реакции при Т = 298 К и давлении взятых газов равном 1,01325 Па (760 мм. рт. ст. = 1 атм), т. е. при температуре 500 К восстановление Ее2О3 водородом не протекает.
 (2000) = -96,61 – 2000(-0,13883) =
(2000) = -96,61 – 2000(-0,13883) =
= -181,05 кДж.
То, что  < 0, указывает на возможность протекания прямой реакции при Т = 298 К и давлении взятых газов равном 1,01325 Па (760 мм. рт. ст. = 1 атм), т. е. при температуре 2000 К восстановление Ее2О3 водородом протекает.
< 0, указывает на возможность протекания прямой реакции при Т = 298 К и давлении взятых газов равном 1,01325 Па (760 мм. рт. ст. = 1 атм), т. е. при температуре 2000 К восстановление Ее2О3 водородом протекает.
Ответ: +96,61 кДж; 138,83 Дж/моль . К; 27,2 кДж; -181,05 кДж.
Задание 114.
Какие из карбонатов ВеСО3, СаСО3 или ВаСО3 - можно получить при взаимодействии соответствующих оксидов с СО2? Какая реакция идет наиболее энергично? Вывод сделайте, вычислив  реакций. Ответ: +31,24 кДж; -130,17 кДж; -216,02 кДж.
реакций. Ответ: +31,24 кДж; -130,17 кДж; -216,02 кДж.
Решение:
Значения  приведены в специальных таблицах.
приведены в специальных таблицах.
а) ВеО (к) + СО2 (г) = ВеСО3 (к)
Находим:
 =
=  (ВеСО3) – [
(ВеСО3) – [ (ВеО) +
(ВеО) +  (CO2)];
(CO2)];
 = -944,75 – [-581,61 + (-394,38)] =
= -944,75 – [-581,61 + (-394,38)] =
= +31,24 кДж
То, что  > 0, указывает на невозможность протекания прямой реакции при Т = 298 К и давлении взятых газов равном 1,01325 Па (760 мм. рт. ст. = 1 атм), т. е. карбонат бериллия нельзя получить из ВеО и СО2 при н.у..
> 0, указывает на невозможность протекания прямой реакции при Т = 298 К и давлении взятых газов равном 1,01325 Па (760 мм. рт. ст. = 1 атм), т. е. карбонат бериллия нельзя получить из ВеО и СО2 при н.у..
б) ВаО (к) + СО2 (г) = ВаСО3 (к)
Находим:
 =
=  (ВаСО3) – [
(ВаСО3) – [ (ВаО) +
(ВаО) +  (CO2)];
(CO2)];
 = -1138,8 – [-528,40 + (-394,38)] =
= -1138,8 – [-528,40 + (-394,38)] =
= -216,02 кДж
То, что  < 0, указывает на возможность протекания прямой реакции при Т = 298 К и давлении взятых газов равном 1,01325 Па (760 мм. рт. ст. = 1 атм), т. е. карбонат бария можно получить из ВаО и СО2 при н.у.
< 0, указывает на возможность протекания прямой реакции при Т = 298 К и давлении взятых газов равном 1,01325 Па (760 мм. рт. ст. = 1 атм), т. е. карбонат бария можно получить из ВаО и СО2 при н.у.
в) СаО (к) + СО2 (г) = СаСО3 (к)
Находим:
 =
=  (СаСО3) – [
(СаСО3) – [ (СаО) +
(СаО) +  (CO2)];
(CO2)];
 = -1128,75– [-604,2 + (-394,38)] =
= -1128,75– [-604,2 + (-394,38)] =
= -130,17 кДж.
То, что  < 0, указывает на возможность протекания прямой реакции при Т = 298 К и давлении взятых газов равном 1,01325 Па (760 мм. рт. ст. = 1 атм), т. е. карбонат кальция можно получить из СаО и СО2 при н.у..
< 0, указывает на возможность протекания прямой реакции при Т = 298 К и давлении взятых газов равном 1,01325 Па (760 мм. рт. ст. = 1 атм), т. е. карбонат кальция можно получить из СаО и СО2 при н.у..
Ответ: +31,24 кДж; -130,17 кДж; -216,02 кДж.
Так как  реакции получения ВеСО3 (-216,02 кДж) больее электроотрицательнее, чем
реакции получения ВеСО3 (-216,02 кДж) больее электроотрицательнее, чем  реакции получения СаСО3 (-130,17 кДж), то реакция получения ВеСО3 идет наиболее энергично.
реакции получения СаСО3 (-130,17 кДж), то реакция получения ВеСО3 идет наиболее энергично.

