Вычисление константы равновесия системы и исходных концентраций реагирующих веществ
Константа равновесия химической реакции
Задание 128.
В гомогенной системе СО + Сl2 ↔ СОСl2 равновесные концентрации реагирующих веществ (моль/л): [СО] = 0,2; [Сl2] = 0,3; [СОСl2] = 1,2. Вычислите константу равновесия системы и исходные концентрации Сl2 и СО. Ответ: Кр = 20; [С12]исх = 1,5 молы/л; [СO]исх = 1.4 молы/л.
Решение:
Уравнение реакции имеет вид:
СО + Сl2 ↔ СОСl2
Выражение константы равновесия данной реакции имеет вид:
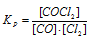
Подставляя в него данные задачи, получим:
Кр = 1,2/(0,2 . 0,3) = 20.
Для нахождения исходных концентраций веществ СО и Cl2 учтём, что, согласно уравнению реакции, из 1 моль Со и 1 моль Cl2 образуется 1 моль COCl2. Поскольку по условию задачи в каждом литре системы образовалось 1,2 моль COCl2, то при этом было израсходовано 1,2 моль СО и 1,2 моль Cl2. Таким образом, искомые исходные концентрации равны:
[С12]исх = 0,3 + 1,2 = 1,5 молы/л;
[СO]исх = 0,2 + 1,2 = 1.4 молы/л.
Ответ: К = 20; [С12]исх = 1,5 молы/л; [СO]исх = 1.4 молы/л.
Задание 129.
В гомогенной системе А + 2В = С равновесные концентрации реагирующих газов (молы/л): [А] = 0,06; [В] = 0,12; [С] = = 0,216. Вычислите константу равновесия системы и исходные концентрации веществ А и В. Ответ: К = 250; [А] = 0,276 моль/л; [В] = 0,552 моль/л.
Решение:
Уравнение реакции имеет вид:
А + 2В ↔ С
Выражение константы равновесия данной реакции имеет вид:
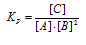
Подставляя в него данные задачи, получим:
Кр = 0,216/[0,06 . (0,12)2] = 250.
Для нахождения исходных концентраций веществ А и В учтём, что, согласно уравнению реакции, из 1 моль А и 2 моль В образуется 1 моль C. Поскольку по условию задачи в каждом литре системы образовалось 0,216 моль C, то при этом было израсходовано 0,216 моль А и 0,432 моль В.
Таким образом, искомые исходные концентрации равны:
[А]исх = 0,06 + 0,216 = 0,276 молы/л;
[В]исх = 0,12 + 0,432 = 0,552 молы/л.
Ответ: Кр = 250; [А] = 0,276 моль/л; [В] = 0,552 моль/л.
Задание 130.
В гомогенной газовой системе А + В С ↔ С + D равновесие установилось при концентрациях (моль/л): [В] = 0,05 и [С] 0,02. Константа равновесия системы равна 0,04. Вычислите исходные концентрации веществ А и В. Ответ: [А] = 0,22 моль/л; [В] = =0,07 молы/л.
Решение:
Уравнение реакции имеет вид:
А + В С ↔ С + D
Обозначим исходную концентрацию вещества А через х. По уравнению реакции в результате взаимодействия веществ А и В образуются одинаковые количества вещества С и D, т. е. равновесные концентрации продуктов будут равны: [С] = [D] = 0,02 моль/л. Подставляем равновесные концентрации веществ в выражение константы равновесия:
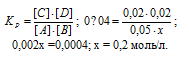
Поскольку по условию задачи в каждом литре системы образовалось 0,02 моль веществ C и D, то при этом было израсходовано 0,02 моль А и 0,02 моль В. Таким образом, искомые исходные концентрации равны:
[А]исх = 0,2 + 0,02 = 0,22 молы/л;
[В]исх = 0,05 + 0,02 = 0,07 молы/л.
Ответ: [А] = 0,22 моль/л; [В] = =0,07 молы/л.
Скорость реакции
Задание 131.
Константа скорости реакции разложения N2O, протекающей по уравнению 2N2O = 2N2 + О2, равна 5 . 10-4. Начальная концентрация N2О равна 6,0 моль/л. Вычислите начальную скорость реакции и её скорость, когда разложится 50% N2O. Ответ: 1,8 . 10-2; 4,5 . 10-3.
Решение:
Уравнение реакции имеет вид:
2N2O = 2N2 + О2
Обозначим начальную концентрацию исходного вещества: [N2O] = a. Согласно закону действующих масс, скорость прямой реакции до изменения концентрации N2O равна:
Vпр = ka2 = 5 . 10-4 . (6)2 = 1,8 . 10-2.
После разложения 50% N2O, концентрация его будет равна 3 моль/л (50 . 6/100 = 3). При новой концентрации N2O скорость прямой реакции ( пр) равна:
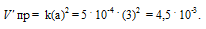
Ответ: 1,8 . 10-2; 4,5 . 10-3.
Задание 132.
Напишите выражение для константы равновесия гетерогенной системы:
СО2 + С ↔ 2СО. Как изменится скорость прямой реакции образования СО, если концентрацию СО2 уменьшить в четыре раза? Как следует изменить давление, чтобы повысить выход СО?
Решение:
Уравнение реакции имеет вид:
СО2 + С ↔ 2СО
При равновесии скорости прямой и обратной реакции равны, а отношение констант этих скоростей постоянно и называется константой равновесия системы:
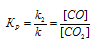
При гетерогенной реакции учитываются только концентрации газообразных веществ. Обозначим концентрацию исходного вещества: [CO2] = a. Согласно закону действующих масс, скорость прямой реакции до изменения концентрации равна: Vпр = ka. После уменьшения концентрации СО2 в 4 раза её значение можно записать так: [CO2] = 1/4a. При новой концентрации СО2 скорость прямой реакции пр будет равна:
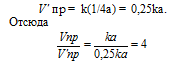
Следовательно, при уменьшении концентрации СО2 в 4 раза скорость прямой реакции уменьшится в 4 раза.Так как в данной системе происходит увеличение объёма (из 1 моль газообразного исходного вещества образуется
2 моль газообразного продукта реакции), то для смещения равновесия в данной системе в сторону прямой реакции – образовании СО надо уменьшить давление в системе.
Задание 133.
Напишите выражение для константы равновесия гетерогенной системы:
С + Н2О (г) ↔ СО + Н2. Как следует изменить концентрацию и давление, чтобы сместить равновесие в сторону обратной реакции - образования водяных паров?
Решение:
Уравнение реакции имеет вид:
С + Н2О (г) ↔ СО + Н2
При равновесии скорости прямой и обратной реакции равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы. В выражении для гетерогенной системы концентрации твёрдых веществ не указываются. Выражение константы равновесия для данной реакции:
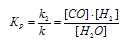
а) Смещение равновесия в сторону образования водяных паров можно достигнуть увеличением концентрации СО или Н2, так и уменьшением концентрации паров воды, так как, согласно принципу Ле Шателье, равновесие в системе сместится в сторону той реакции, которая ослабляет это воздействие.
б) Так как в данной системе из углерода и водяных паров образуются углекислый газ и водород, т. е. в данной системе увеличивается объём (из 1 моль газа образуется 2 моль газов), то для смещения равновесия в сторону образования паров воды надо увеличить давление.
Равновесие гомогенной системы
Задание 134.
Равновесие гомогенной системы: 4НСl (г) + О2 ↔ 2Н2О (г) + 2Сl2 (г), установилось при следующих концентрациях реагирующих веществ (молы/л): [Н2O]P = 0,14; [С12]P = 0,14; [НСl]P = 0,20; [O2]р = О,32. Вычислите исходные концентрации хлороводорода и кислорода. Ответ: [НСl]исх = 0,48 моль/л; [О2]исх = 0,39 моль/л.
Решение:
Уравнение реакции имеет вид:
4НСl (г) + О2 ↔ 2Н2О (г) + 2Сl2 (г)
Для нахождения исходных концентраций хлороводорода и кислорода учтём, что согласно уравнению реакции из 4 моль HCl 1 моль О2 образуется 2 моль Н2О и 2 моль Cl2. Поскольку по условию задачи в каждом литре системы образовалось 0,14 моль Н2О и 0,14 моль Cl2, то при этом было израсходовано
0,14 . 4/2 = 0,28 моль HCl и , 14 . 1/2 = 0,07 моль Cl2. Таким образом, искомые концентрации HCl и Cl2 равны:
[НСl]исх = [НС1]P + 0,28 =
= 0,20 + 0,28 = 0,48 моль/л;
[О2]исх = [О2]P + 0,07 =
= 0,32 + 0,07 = 0,39 моль/л.
Ответ: [НСl]исх = 0,48 моль/л; [О2]исх = 0,39 моль/л.

