Вычисление молярной, моляльной, нормальнои концентрации растворов
Решение задач по химии на выражение концентрации раствора
Задание 141.
Вычислите молярную концентрацию и молярную концентрацию эквивалента 20%-ного раствора хлорида кальция плотностью 1,178 г/см3. Ответ: 2,1 М; 4,2 Н.
Решение:
а) Молярная (мольно-объемная) концентрация показывает число молей растворенного вещества, содержащегося в1 л раствора. Масса 1 л раствора составляет 1000 . 1,178 = 1178 г. Массу хлорида кальция в литре раствора находим из соотношения:
100 : 20 = 1178 : x;
x = (1178 . 20)/100 = 235,6 г.
Молярную концентрацию получим делением числа граммов СаCl2 в 1 л раствора на молярную массу СаCl2 (111,17 г/моль):
CM = 235,6/111,17 = 2,1M.
б) молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора.
Так как эквивалентная масса СаCl2 = М/2 = 111,17/2 = 55,585 г/моль, то
Cн = 235,6/55,585 = 4,2 н.
Ответ: 2,1 М; 4,2 Н.
Задание 142.
Чему равна молярная концентрация эквивалента 30%-ного раствора NаОН плотностью 1,328 г/см3? К 1 л этого раствора прибавили 5 л воды. Вычислите массовую (процентную) долю полученного раствора. Ответ: 9,96 н.; 6,3%.
Решение:
а) молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора. Масса 1 л раствора составляет 1328 г
(1000 . 1,328 = 1328 ). Массу NaOH в литре раствора находим из соотношения:
100 : 30 = 1328 : x;
x = (1328 . 30)/100 = 398,4 г.
Так как эквивалентная масса NaOH = М/1 = 40/1 = 40 г/моль, то
Cн = 398,4/40 = 9,96 H.
б) Массовая концентрация показывает число граммов (единиц массы) вещества, содержащееся в 100 г (единиц массы) раствора. Масса раствора составляет 1328 + 5000 = 6328 г. Массовую (процентную) долю полученного раствора находим из соотношения:
6328 : 398,4 = 100 : х;
х = (398,4 . 100)/6328 = 6,3%.
Ответ: 9,96 н.; 6,3%.
Задание 143.
К 3 л 10%-ного раствора HNO3 плотностью 1,054 г/см3 прибавили 5 л 2%-ного раствора той же кислоты плотностью 1,009 г/см3. Вычислите массовую (процентную) и молярную концентрации полученного раствора, объем которого равен 8 л. Ответ: 5,08%; 0,82 М.
Решение:
Масса трёх литров 10%-ного раствора HNO3 равна 3000 . 1,054 = 3162 г. В этом растворе содержится 3162 . 10/100 = 316,2 г HNO3. Масса 5 л 2%-ного раствора 5000 . 1,009 = 5045 г. В этом растворе содержится 5045 . 2/100 = 100,9 г HNO3.
В общем объеме полученного раствора (8 л) содержание HNO3 составляет 100,9 + 316,2 = 417,1 г. Масса раствора после смешения равна 3162 + 5045 = 8207 г.
Массовую (процентную) концентрацию определим по уравнению:
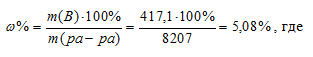
m(B) – масса растворённого вещества; m(ра-ра) – масса раствора, которая составляет сумму масс растворителя и растворённого вещества [m(ра-ра) = m(ра-ля) + m(В); - массовая доля растворённого вещества в процентах.
Молярная концентрация раствора:
СМ = (417,1 . 1000)/(8000 . 63) = 0,83М, где
63 г/моль - молярная масса HNO3.
Ответ: 5,08%; 0,82 М.
Задание 144.
Вычислите молярную концентрацию эквивалента и моляльную концентрацию 20,8%-ного раствора HNO3 плотностью 1,12 г/см3. Сколько граммов кислоты содержится в 4 л этого раствора? Ответ: 3,70 н.; 4,17 М; 931,8 г.
Решение:
Масса 1 л раствора HNO3 составляет 1000 . 1,12 = 1120 г Массу кислоты в 1 л раствора находим из соотношения:
100 : 20,8 = 1120 : x;
x = (1120 . 20,8)/100 = 232,96 г.
а) молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора.
Так как эквивалентная масса HNO3 = М/1 = 63/1 = 63 г/моль, то
Cн = 232,96/63 = 3,7 н.
б) моляльная концентрация (или моляльность) показывает число молей растворенного вещества, содержащихся в 1000 г растворителя. Массу HNO3 в 1000 г растворителя находим из соотношения:
1000 : x = (1120 – 232,96) : 232/96;
x = (1120 . 232,96)/ (1120 – 232,96) = 262,63 г.
Отсюда
Cm = 262,63/63 = 4,17 M.
Задание 145.
Вычислите молярную концентрацию эквивалента, молярную и моляльную концентрации 16%-ного раствора хлорида алюминия плотностью 1,149 г/см3. Ответ. 4,14 н.; 1,38 М; 1,43 М.
Решение:
а) молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора. Масса 1 л раствора составляет 1000 . 1,149 = 1149 г. Массу хлорида алюминия в 1 л раствора находим из пропорции:
100 : 16 = 1149 : x;
x = (1149 . 16)/100 = 183,84 г.
Так как эквивалентная масса AlCl3 = М/3 = 133,6/3 = 44,5 г/моль, то
Cн = 183,84/44,5 = 4,13 Н.
б) Молярная (мольно-объемная) концентрация показывает число молей растворенного вещества, содержащегося в 1 л раствора.
Молярную концентрацию получим делением числа граммов AlCl3 в 1 л раствора на молярную массу AlCl3 (133,6 г/моль):
CM = 183,84/133,6 = 1,38 M.
в) моляльная концентрация (или моляльность) показывает число молей растворенного вещества, содержащихся в 1000 г растворителя. Массу AlCl3 в 1000 г растворителя находим из соотношения:
1000 : x = (1149 – 183,84) : 183,84;
x = (1149 . 183,84)/ (1149 – 183,84) = 190,48 г.
Отсюда
Cm = 190,48/133,6 = 1,43 M.
Ответ. 4,13 н.; 1,38 М; 1,43 М.
Задание 146.
Сколько и какого вещества останется в избытке, если к 75 см3 0,3 н. раствора Н2SO4 прибавить 125 см3 0,2 н. раствора КОН? Ответ: 0,14 г КОН.
Решение:
Уравнение реакции имеет вид:
H2SO4 + 2KOH = K2SO4 + 2H2O
Вещества реагируют друг с другом в эквивалентных количествах, т.е. по уравнению реакции 2 эквивалента H2SO4 реагируют с двумя эквивалентами КОН. Находим количество эквивалентов H2SO4 в растворе из пропорции:
1000 : 0,3 = 75 : x;
x = (75 . 0,3)/1000 = 0,0225 н.
Тогда количество эквивалентов КОН равно:
1000 : 0,2 = 125 : x;
x = (125 . 0,2)/1000 = 0,025 н.
Из расчетов количества эквивалентов видно, что количество эквивалентов КОН больше, чем H2SO4
(0,025 > 0,0225), значит, КОН взят в избытке. Находим количество избытка КОН:
0,025 – 0,0225 = 0,0025 н. Тогда масса избытка КОН равна:
m(KOH) = (KOH) . M(KOH) =
= 0,0025 . 56,1 = 0,14 г.
Ответ: 0,14 г.
Задание 147.
Для осаждения в виде АgСI всего серебра, содержащегося в 100 см3 раствора AgNO3, потребуется 50 см3 0,2 н. раствора HCl. Какова молярная концентрация эквивалента раствора AgNO3? Какая масса АgСI выпала в осадок? Ответ: 0,1 н.; 1,433 г
Решение:
Уравнение реакции имеет вид:
AgNO3 + HCl = AgCl↓+ HNO3
Согласно закону эквивалентов:
СН (1) . V(1) = СН(2) . V(2)
Значит, объёмы реагирующих растворов обратно пропорциональны нормальности этих растворов. Исходя из этого, находим нормальность раствора AgNO3:
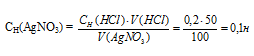
Количество AgCl равно количеству AgNO3 [n (AgCl) = n(AgNO3). Находим количество AgNO3 в 100 см3 0,1Н его раствора из пропорции:
1000 : 01 = 100 : х;
х = (100 . 0,1)/1000 = 0,01 Н или 0,01 М.
Отсюда находим массу AgCl:
m(AgCl) = n(AgCl) . M(AgCl) = 0,01 . 56,1 = 0,14 г.
m(KOH) = n(KOH) . M(KOH) = 0,0025 . 143,3 = 1,43 г.
Ответ: 0,1 н.; 1,433 г.

