Расчет молярной массы эквивалента металла по массе его нитрата
Задание З.
Из 1,35 г оксида металла получается 3,15 г его нитрата. Вычислите молярную массу эквивалента этого металла.
Решение:
Нужно иметь в виду:
а) молярная масса эквивалента оксида равна сумме молярных масс эквивалентов металла и кислорода;
б) молярная масса эквивалента соли равна сумме молярных масс эквивалентов металла и кислотного остатка.
Так как МЭ(О) = 8 г/моль, МЭ(NO3) = 62 г/моль, то учитывая сказанное и, подставив соответствующие данные в уравнение:
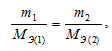
т. е. эквивалентные массы реагирующих веществ m1 и m2 пропорциональны их молярным массам, получим:
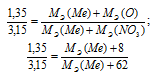
Откуда
1,35 . [МЭ(Ме) + 62] = 3,15 . [МЭ(Ме) + 8];
1,35МЭ(Ме) + 83,7 = 3,15МЭ(Ме) + 25,2;
(83,7 – 25,2) = [3,15МЭ(Ме) – 1,35МЭ(Ме)];
1,8МЭ(Ме = 58,5;
МЭ(Ме = 58,5/1,8;
МЭ(Ме) = 32,5 г/моль.
Ответ: 32,5 г/моль.

