Вычисление понижения давления газа при указанной температуре
Задача 475
При 315 К давление насыщенного пара над водой равно 8,2 кПа (61,5 мм рт. ст.). На сколько понизится давление пара при указанной температуре, если в 540 г воды растворить 36 г глюкозы С6Н12О6?
Решение:
M(С6Н12О6) = 180,г/моль, М(Н2О) – 18,г/моль.
Для расчета по формуле P1 = N1P0 нужно вычислить мольную долю растворителя N1. Мольная масса воды равна 18,г/моль, мольная масса глюкозы - 180 г/моль. Количество воды и сахарозы соответственно равны:
n1 = 540/18 = 30 моль;
n2 = 36/180 = 0,2 моль.
Находим мольную долю воды:
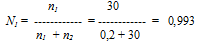
Следовательно,
Р1= 0,993 . 8,2 = 8,14 кПа.
Понижение давления пара находим по формуле:
 Р = Р0 - Р1 = 8,2 – 8,14 = 0,06кПа
Р = Р0 - Р1 = 8,2 – 8,14 = 0,06кПа
Ответ: 0,06кПа.
Задача 476.
При 293 К давление насыщенного пара над водой равно 2,34 кПа (17,53 мм рт. ст.). Сколько граммов глицерина С3Н5(ОН)3 надо растворить в 180 г воды, чтобы понизить давление пара на 133,3 Па (1 мм рт. ст.)?
Решение:
M[С3Н5(ОН)3] = 92г/моль, М(Н2О) = 18,г/моль.
Из формулы:  Р = Р0 - Р1 находим давление пара над раствором Р1, получим:
Р = Р0 - Р1 находим давление пара над раствором Р1, получим:
Р1 - Р0 -  Р = 2,34 – 0,1333 =
Р = 2,34 – 0,1333 =
= 2,2067кПа.
Из формулы P1 = N1P0 находим мольную долю растворителя N1, получим:
N1=P1/P0 = 2,2067/2,34 = 0,943.
Из уравнения 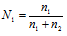
где n1 – число молей растворителя, n2 – число молей растворенного вещества получим выражение для расчета числа молей растворённого вещества глицерина, получим: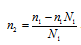
Количество воды равно: n1 = 18/18 = 10 моль;
Находим количество глицерина: 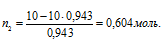
Находим массу глицерина из формулы n2 = m/M, где m – масса вещества; М – мольная масса вещества.
Тогда
m = n2M =0,604 . 92 = 55,6г.
Ответ: 55,6г.
Задача 477.
На сколько градусов повысится температура кипения воды, если в 100 г воды растворить 9 г глюкозы С6Н12О6?Решение:
М(С6Н12О6) = 180г/моль. Для расчетов используем уравнение:
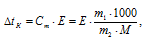
где СМ - моляльная концентрация, рассчитаем по уравнению:
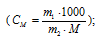
где
m1 - масса растворённого вещества; m2 - масса растворителя; М – молярная масса растворённого вещества; Е – эбуллиоскопическая константа (для воды Е = 0,52);  tкип. - повышение температуры кипения.
tкип. - повышение температуры кипения.
Находим повышение температуры кипения растворов глюкозы:
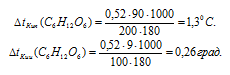
Ответ: на 0,26 град.
Задача 478.
При какой приблизительно температуре будет кипеть 50%-ный (по массе) раствор сахарозы C12H22О11?
Решение:
M(С12Н22О11) = 342г/моль.
При пересчете на 1000 г Н2О содержание сахарозы в растворе равно 500 г. Поскольку мольная масса сахарозы составляет 342 г/моль, то моляльность раствора рассчитаем по уравнению:
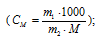 где
где
m1 - масса растворённого вещества; m2 - масса растворителя; М – молярная масса растворённого вещества; Е – эбуллиоскопическая константа (для воды Е = 0,52);  tкип. - повышение температуры кипения.
tкип. - повышение температуры кипения.
Находим повышение температуры кипения растворов сахарозы:
СМ = (500 . 1000)/(1000 . 342) =
= 1,46 моля на 1000 г Н2О.
По формуле  tкип. = Еm находим:
tкип. = Еm находим:  tкип. = 0,52 . 1,46 = 0,76 град. Следовательно, водный раствор сахарозы будет кипеть при 100,76 °С, т.е. приблизительно при 101 °С.
tкип. = 0,52 . 1,46 = 0,76 град. Следовательно, водный раствор сахарозы будет кипеть при 100,76 °С, т.е. приблизительно при 101 °С.
Ответ: 101 °С.

