Вычисление молярности раствора и осмотического давления раствора
Задача 471.
Сколько молей неэлектролита должен содержать 1 л раствора, чтобы его осмотическое давление при 25 °С было равно 2,47 кПа?
Решение:
Молярность раствора рассчитаем из формулы: Р = СМRT, где СМ – молярная концентрация, R – газовая постоянная [8,314 Дж/(моль . К)], T – температура.
Тогда
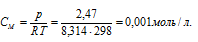
Молярность раствора – количество молей растворённого вещества в 1 л раствора, т.е. в 0,001 М растворе содержится 0,001 молей вещества.
Ответ: 0,001 М.
Задача 472.
В 1 мл раствора содержится 1018 молекул растворенного неэлектролита. Вычислить осмотическое давление раствора при 298 К.
Решение:
По условию задачи в 1мл раствора содержится 1018 молекул растворённого вещества, значит, в 1 л его содержится 1021 молекул. Таким образом, Молярную концентрацию раствора рассчитаем по формуле:
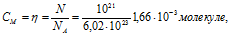
где
n - количество растворённого вещества, N – количество молекул вещества в 1 л раствора, NA – число Авогадро.
Осмотическое давление находим по уравнению: Р = СМRT, где СМ – молярная концентрация, R – газовая постоянная [8,314 Дж/(моль . К)], T – температура.
Тогда
Р = СМRT = (1,66 . 10-3) . 8,314 . 298 = 4,1 кПа.
Ответ: 4,1 кПа.
Задача 473.
Найти при 65 °С давление пара над раствором, содержащим 13,68 г сахарозы C12H22О11 в 90 г Н2О, если давление насыщенного пара над водой при той же температуре равно 25,0 кПа (187,5 мм. рт. ст.).
Решение:
Для расчета по формуле P1 = N1P0 нужно вычислить мольную долю растворителя N1. Мольная масса воды равна 18,02 г/моль, мольная масса сахарозы - 342 г/моль. Количество воды и сахарозы соответственно равны:
n1 = 90/18,02 = 4,994 моль;
n2 = 13,68/342 = 0,040 моль.
Находим мольную долю воды:
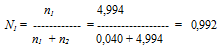
Следовательно,
Р1= 0,992 . 25,0 =
= 24,8 кПа (186,0 мм.рт.ст.)
Ответ: 24,8 кПа (186,0 мм.рт.ст.).
Задача 474.
Чему равно давление насыщенного пара над 10% раствором карбамида CO(NH2)2 при 100 °С?
Решение:
M[CO(NH2)2] = 60,02 г/моль, М(Н2О) – 18,02 г/моль. Для расчётов используем уравнение Р1 = Р0 – [P0n2/n1 + n2]. P0– давление пара растворителя (для воды при 100 °С составляет 101,3 кПа), Р1 – давление пара раствора, n1 – число молей растворителя, n2 – число молей растворенного вещества.
Количество воды и карбамида соответственно равны:
n1 = 90/18,02 = 4,994 моль;
n2 = 10,00/60,02 = 0,167 моль.
Отсюда
Р1 = 101,3 – [101,3 . 0,167/4,994 + 0,167] = 98 кПа.
Ответ: 98 кПа.

