Определение массовой доли каждого из гидроксидов в исходном растворе
Задача 2.
В некотором сосуде находится раствор, содержащий одновременно два гидроксида: КОН и Ва(ОН)2. На полную нейтрализацию 30 г этого раствора расходовалось 12 мл 20% -ного раствора НС1 (р = 1,1 г/мл). При добавлении к 30 г такого же исходного раствора щелочей избытка раствора сульфата натрия выпало 2,3 г осадка. Определите массовую долю каждого из гидроксидов в исходном растворе.
Дано:
масса исходного раствора щелочей: mр-ра щелочей = 30 г;
объем раствора соляной кислоты: Vр-ра НСl = 12 мл;
массовая доля НС1 в соляной кислоте:  (НСl) = 20%;
(НСl) = 20%;
плотность раствора соляной кислоты: рр-ра HCl = 1,1 г/мл;
масса осадка: mосадка = 2,3 г.
Найти:
массовую долю КОН в исходном растворе щелочей:  (КОН) = ?
(КОН) = ?
массовую долю Ва(ОН)2 в исходном растворе щелочей:  (Ва(ОН)2) = ?
(Ва(ОН)2) = ?
Решение:
Данная задача является комплексной и кроме рассматриваемого типа задач включает в себя тему «растворы».
Сначала проанализируем химические превращения, описанные в задаче.
1. Добавление соляной кислоты к исходному раствору щелочей приводит к одновременному протеканию двух реакций нейтрализации:
КОН + НС1 = КС1 + Н2О (№ 1);
Ва(ОН)2 + 2НС1 = ВаС12 + 2Н2О (№ 2).
2. Сульфат натрия является селективным реактивом на ионы Ва2+, находящиеся в растворе. При добавлении Nа2SО4 к исходному раствору щелочей идет реакция только с гидроксидом бария. В результате выпадает осадок сульфата бария.
Ва(ОН)2 + Nа2SО4 = ВаSО4↓+ 2 NаОН (№ 3)
Таким образом, по массе осадка, которая указана в условии, возможно определить массу Ва(ОН)2 в 30 г исходного раствора двух гидроксидов. Далее по данным о нейтрализации соляной кислоты и используя полученную ранее информацию о содержании Ва(ОН)2 возможно найти массу (КОН). После чего определим массовую долю каждого из гидроксидов в исходном растворе.
Алгоритм решения можно представить следующим образом:
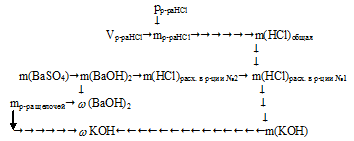
1. По реакции № 3 определим массу гидроксида бария в 30 г исходного раствора.
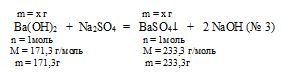
Составим пропорцию:
х г Ва(ОН)2 дают 2,3 г ВаSО4 (по данным условия)
171,3 г Ва(ОН)2 дают 233,3 г ВаSО4 (по уравнению)
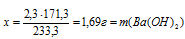
(содержалось в 30 г исходного раствора щелочей).
2. По реакции №2 определим массу НСl, которая расходовалась на нейтрализацию Ва(ОН)2 в первой 30-граммовой порции исходного раствора щелочей.
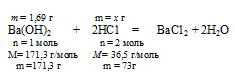
Составим пропорцию:
1,69г Ва(ОН)2 взаимодействуют с х г НСl (по условию);
171,3 г Ва(ОН)2 взаимодействует с 73 г НСl (по уравнению).
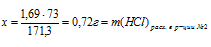
(расходовалось НСl на нейтрализацию Ва(ОН)2.
3. По данным об объеме и плотности определим массу раствора соляной кислоты. Далее, используя массовую долю НСl в растворе, найдем массу хлороводорода.
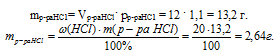
4. Определим массу НС1, израсходованной на нейтрализацию КОН в уравнении №1.
m(НСl)расх. в р-ии № 1 = m(НСl)общая – m(НСl)расх. в р-ии № 2 = 2,64 – 0,72 = 1,92 г.
5. П о уравнению реакции № 1 определим массу КОН в 30 г исходного раствора.
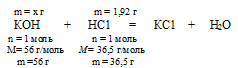
Составим пропорцию:
х г КОН взаимодействует с 1 ,92 г НСl (по условию)
56 г КОН взаимодействуете 36,5 г НСl (по уравнению)
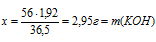
(содержалось в 30 г исходного раствора щелочей).
6. Определим массовые доли каждого из гидроксидов в исходном растворе.
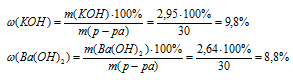
Ответ:  (КОН) = 9,8%;
(КОН) = 9,8%;  (Ва(ОН)2) = 8,8%.
(Ва(ОН)2) = 8,8%.

