Решение задач на селективное разделение смесей
Определение массовой доли каждого металла в исходном сплаве
Задача 1.
Сплав меди с серебром обработали избытком концентрированной азотной кислоты. Масса полученных нитратов составила 49 г. Далее к полученному раствору добавили избыток бромоводородной кислоты. В результате выпало 50 г осадка. Определите массовую долю каждого металла в исходном сплаве.
Дано:
масса нитратов металлов: mсолей = 49 г;
масса осадка: mосадка = 50 г.
Найти:
массовую долю меди в исходном сплаве:  (Сu) = ?
(Сu) = ?
массовую долю серебра в исходном сплаве:  (Аg) = ?
(Аg) = ?
Решение:
В данном случае сплав двух металлов можно рассматривать как смесь индивидуальных веществ1. Сначала проанализируем химические превращения, описанные в условии.
1. С концентрированной азотной кислотой взаимодействуют оба метала:
Сu + 4НNО3 = Сu(NO3)2 + 2NO2↑+ 2Н2О.
2. С образованием осадка с бромводородной кислотой взаимодействует только нитрат серебра. НВг в данном случае является селективным реактивом иа АgNО3:
АgNО3 + НВг = AgBr↓ +HNO3.
Таким образом, по массе осадка AgBr можно определить массу АgNО3 в смеси нитратов, и используя общую массу нитратов, рассчитать массу нитрата меди. Далее по реакциям с НNО3 возможно определить массу каждого из металлов в исходном сплаве и найти их массовые доли.
Алгоритм решения можно представить следующим образом:
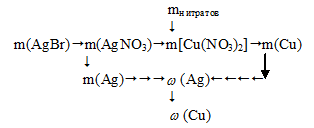
3. По уравнению с образованием осадка определяем массу нитрата серебра.
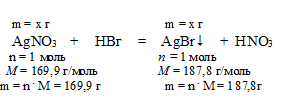
Составим пропорцию:
х г АgNО3дает 50 г AgBr (по данным условия)
169,9 г АgNО3 дает 187,8 г AgBr (по уравнению)
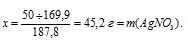
4. Используя общую массу нитратов, определяем массу нитрата меди (II).
m[Сu(NO3)2] = mнитратов – m(АgNО3) =
= 49 – 45,2 = 3,8 г.
5. Определяем массу меди в нитрате меди. Это можно сделать по уравнению реакции взаимодействия меди с азотной кислотой, а можно по самой формуле нитрата.
М[Сu(NO3)2] = М(Сu) + М(N) . 2 + М(О) . 3 . 2 =
= 63, 5 + 28 + 96 = 187, 5 г/моль.
Составим пропорцию:
В 187,5 г Сu(NO3)2 содержится 63,5 г Сu (по значению М);
В 3,8 г Сu(NO3)2 содержится х г Сu (по условию задачи).
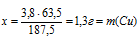
(масса меди в исходном сплаве).
6. Также определяем массу серебра в 45,2 г нитрата серебра.
М(АgNО3) = m(Ag) + M(N) + М(О) . 3 =
= 107,9 + 14 + 48 = 169,9 г/моль.
Составим пропорцию:
В 169,9 г АgNО3содержится 107,9 г Аg (по значению М)
В 45,2г АgNО3содержится х г Аg (по условию задачи)
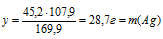
(масса серебра в исходном сплаве).
7. Находим массовую долю серебра в сплаве.
8. Находим массовую долю меди в сплаве.
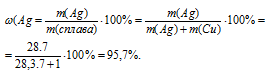
 (Сu) = 100% –
(Сu) = 100% –  (Аg) = 100% – 95,7 = 4,3%
(Аg) = 100% – 95,7 = 4,3%
Ответ:  (Аg) = 95,7% ;
(Аg) = 95,7% ;  (Сu) = 4,3%.
(Сu) = 4,3%.
Комментарии:
1На самом деле сплав металлов не является смесью невзаимодействующих друг с другом веществ. В них по меньшей мере реализуется металлический тип химической связи между атомами разных элементов. Такие сплавы могут представлять собой твердые растворы (аналогичные жидким) или еще более сложные и высокоорганизованные структуры (с которыми вы познакомитесь в вузе). Но можно считать, что в описанных в условии реакциях данный сплав будет себя вести так же, как и механическая смесь медных и серебряных опилок.

