Решения задач, объединяющих в себе растворы и химические реакции
Определение массовой доли растворенного вешества
Приведены алгоритмы решения задач, которые объединяют в себе растворы и химические реакции. При их решении следует сначала записать все уравнения химических реакций, а затем составлять алгоритм. В таких задачах необходимо учитывать возможность образования осадка, выделения газа, участия воды в химических реакциях.
Задача 3.
Для реакции с 200 г водного раствора нитрата серебра потребовалось 70 г 3%-ного раствора СаС12 в воде. Определите массовую долю АgNО3 в исходном растворе и массовую долю соли в полученном растворе.
Дано:
масса раствора нитрата серебра: mр-ра(АgNО3) = 200 г;
масса раствора хлорида кальция: mр-ра(СаСl2) = 70 г;
массовая доля хлорида кальция в исходном р-ре:  (СаС12) = 3%.
(СаС12) = 3%.
Найти:
массовую долю АgNО3в исходном р-ре:  (АgNО3)в исх. р-ре = ?
(АgNО3)в исх. р-ре = ?
массовую долю соли в полученном растворе: (соли)в кон. р-ре = ?
Решение:
В реакцию вступает нитрат серебра и хлорид кальция. Вода, образующая растворы этих веществ, во взаимодействии не участвует. Записываем уравнение реакции:
2АgNО3 + СаСl2 = 2AgCl↓ + Са(NО3)2.
В результате реакции одна из получающихся солей нерастворима и выпадает в осадок, следовательно, во втором вопросе задачи требуется определить массовую долю нитрата кальция в конечном растворе:
(СаNО3)2)в кон. p-ре = ?
Возможно несколько алгоритмов решения данной задачи, например:
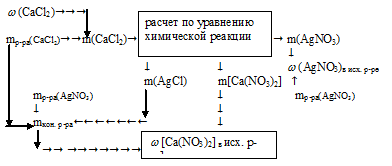
1. Определяем массу СаСl2 в 70 г 3% -ного раствора.
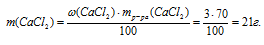
2. По уравнению реакции определяем массы AgNO3; AgCl и Ca(NO3)2:
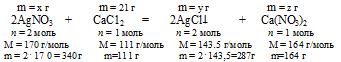
Составим пропорции:
х г АgNО3 взаимодействует с 21 г СаСl2 (по данным условия);
340 г АgNО3 взаимодействует со 111 г СаСl2 (по уравнению);
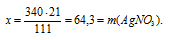
21 г СаС12 дает у г AgCl (по данным условия);
1 1 1 г СаС12 дают 287 г AgCl (по уравнению);
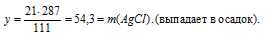
21 г СаСl2 дает г Са(NО3)2 (по данным условия);
111 г СаСl2 дают 164 г Са(NО3)2 (по уравнению);
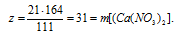
3. Определяем массовую г АgNО3 в исходном растворе.
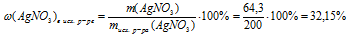
4. Определяем массу конечного раствора после реакции. Так как хлорид серебра в результате реакции выпадает в осадок, можно записать:
mкон. р-ра = mp-pa(CaCl2) + mp-pa(AgNO3) – m(AgCl)в осадке =
= 70 + 200 – 54,3 = 215,7 г.
5. Определяем массовую долю Са(NО3)2 в конечном растворе.
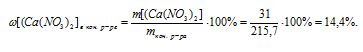
Ответ:  (AgNO3)в исх.р-ре = 32,15%
(AgNO3)в исх.р-ре = 32,15%  [Са(NО3)2]в кон. р-ре = 14,4%.
[Са(NО3)2]в кон. р-ре = 14,4%.
Определение массы растворенного вешества
Задача 4.
Определите массу 3%-ного водного раствора NаОН, который необходимо добавить к 50,0 г Ка для получения 49% - ного раствора NаОН в воде.
Дано:
массовая доля NаОН в исходном р-ре:  ; (NаОН)в исх. р-ре = 3%;
; (NаОН)в исх. р-ре = 3%;
масса натрия: m(Nа) = 50 г;
массовая доля NаОНв конечном р-ре: (МаОН)в кон. р-ре = 49%.
(МаОН)в кон. р-ре = 49%.
Найти:
массу исходного раствора: mисх.р-ра = ?
Решение:
Когда мы раствор NаОН в воде добавляем к металлическому .натрию, происходит реакция Nа с водой из исходного раствора. NаОН, который исходно находился в растворе, участия в реакции не принимает. Из конечного раствора выделяется газообразный водород.
2Nа + 2Н2О = 2NаОН + Н2↑.
Отобразим условие задачи в виде рисунка:
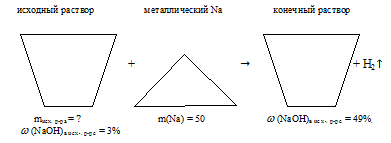
Решение данной задачи возможно лишь по встречному алгоритму.
1. Искомой величиной является масса 3%-ного раствора NаОН. Обозначим ее значением «а». Используя mисх. р-ра = а, как известную величину, составляем встречный алгоритм.
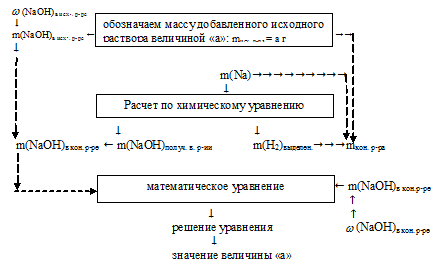
2. Используя значение массы исходного раствора как известную величину, находим массу NаОН в исходном растворе:
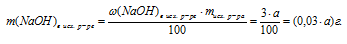
3. Используя указанную в условии массу натрия, по уравнению реакции находим массы NаОН и Н2, полученные в результате взаимодействия:
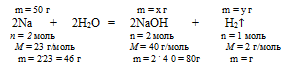
Составим пропорции:
50 г Nа дают х г NаОН (по данным условия);
46 г Nа дают 80 г NаОН (по уравнению реакции);
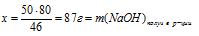
50 г Nа дают y г H2 (по данным условия);
46 г Nа дают 2 г H2 (по уравнению реакции)
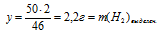
3. По полученным данным находим массу NаОН в конечном растворе.
m(NаОН)в кон. р-ре =
= m(NаОН)в исх. р-ре + m(NаОН)кон. в реакции =
= (0,03 . a + 87) г.
4. Находим массу конечного раствора.
mкон. р-ра = mисх. р-ра + m(Nа) – m(H2)выдел. =
= а + 50 – 2,2 = (а + 47,8) г.
5. Определяем массу NаОН в конечном растворе:
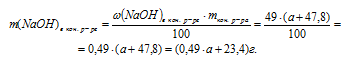
6. В предыдущих действиях мы определили массу NаОН в конечном растворе двумя разными путями. Но так как конечный раствор NаОН один и тот же, то и содержание NаОН в нем одно и тоже. Это позволяет нам приравнять два полученных выражения и получить одно математическое уравнение с одним неизвестным:
0,03 . а + 87 = 0,49 . а + 23,4
Решая его, получаем: а = 138 г.
Величиной «а» мы обозначали массу исходного 3%-ного раствора NОН.
Ответ: необходимо 138 г исходного 3% -ного раствора NаОН.

