Алгоритм решения задач, объединяющих в себе растворы и химические реакции
Определение массы растворенного вещества
Есть задачи, которые объединяют в себе растворы и химические реакции. При их решении следует сначала записать все уравнения химических реакций, а затем составлять алгоритм. В таких задачах необходимо учитывать возможность образования осадка, выделения газа, участия воды в химических реакциях.
Задача 1.
Определите массу 2% -ного раствора NаОН в воде, необходимого для полной нейтрализации 50 г 10% -ного раствора Н2SО4 в воде.
Дано:
массовая доля гидроксида натрия в растворе:  (NаОН) = 2% ;
(NаОН) = 2% ;
массовая доля серной кислоты в растворе:  ( Н2SО4) = 10% ;
( Н2SО4) = 10% ;
масса раствора серной кислоты: mр.ра( Н2SО4)= 50 г.
Найти:
массу раствора гидроксида натрия: m(р-ра NaOH) = ?
Решение:
В реакцию нейтрализации вступает гидроксид натрия и серная кислота. Вода, образующая растворы этих веществ, во взаимодействии не участвует. Полная нейтрализация кислоты основанием предполагает образование средней соли. Записываем уравнение реакции:
Н2SО4 + 2NаОН = Na2SО4 + 2Н2О.
Составляем алгоритм решения:
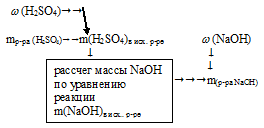
1. Находим массу серной кислоты в 50 г 10% -ного раствора.
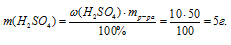
2. По уравнению находим массу гидроксида натрия, необходимого для полной нейтрализации 5 г серной кислоты:
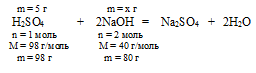
Составляем пропорцию:
5 г Н2SО4 нейтрализуются х г NаОН (по данным задачи)
98 г Н2SО4 нейтрализуются 80 г NаОН (по уравнению)
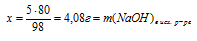
3. Находим массу раствора, содержащего 4,08 г NаОН:
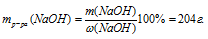
Ответ: потребуется 204 г 2% -ного раствора NаОН.
Определение массовой доли растворенного вещества
Задача 2.
50 г натрия полностью прореагировали с 400 г воды. Определите массовую долю щелочи в растворе после реакции.
Дано:
масса натрия: m(Nа) = 50 г;
масса воды: m(Н2О) = 400 г.
Найти:
массовую долю щелочи в растворе:  (NаОН) = ?
(NаОН) = ?
Решение:
Запишем реакцию натрия с водой:
2Nа + 2Н2О = 2NаОН + Н2↑.
Решение данной задачи возможно по нескольким алгоритмам. Воспользуемся одним из них:

1. По уравнению реакции находим массу NаОН и и массу водорода, получившихся в результате реакции.
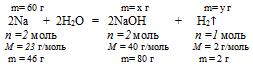
Составляем 2 пропорции:
50 г Nа дают х г NаОН (по данным условия);
46 г Nа дают 80 г NаОН (по уравнению реакции);
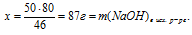
50 г Nа дают у г Н2(по данным условия);
46 г Nа дают 2 г Н2;
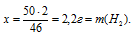
2. Находим массу конечного раствора. Она будет равна сумме масс исходной воды и натрия. Кроме того, водород, являющийся газом, выделяется из раствора, поэтому его массу придется вычесть из общей массы.1
mр-ра = m(Н2О)исх. + m(Nа)исх. – m(Н2)выделилось =
= 400 + 50 – 2,2 = 447,8 г.
3. Находим массовую долю NаОН в конечном растворе.
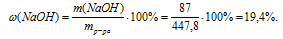
Ответ: (NaOH) = 19,4%.
(NaOH) = 19,4%.
Комментарии:
1 Массу раствора можно было определить и иначе. Для этого необходимо было определить массу расходовавшейся в реакции воды и массу оставшейся воды:
m(Н2О)оставш. = m(Н2О)исх. - m(Н2О) расх.
Далее определить массу раствора:
mр-ра = m(NаОН) + m(Н2О)оставш.

