Решение задач с участием в химических реакциях только одного из компонентов смеси
Задача 1.1
Образец известняка, содержащий 12% примеси песка (SO2), залили избытком раствора соляной кислоты (НСl). Определите объем выделившегося газа (н.у.), если масса исходного образца была 70 г.
Дано:
масса исходного образца известняка: mисх. обр. = 70 г;
массовая доля примеси песка:  SiO2 = 12%.
SiO2 = 12%.
Найти:
объем выделившегося газа: V(СО2) = ?
Решение:
В данной задаче образец известняка представляет собой смесь: СаСО3 + SiO2. С соляной кислотой взаимодействует только один из ее компонентов — карбонат кальция. Второй же компонент (песок SiO2) представляет собой неактивную примесь. Поэтому мы записываем химическую реакцию взаимодействия с соляной кислотой только для СаСО3.
СаСО3 + 2НСl = СаС12 + СО2↑ + Н2О.
Но в условии задачи указана масса всего образца вместе с примесью. Поэтому на начальном этапе решения необходимо выявить количество (в данном случае массу) активного компонента в образце. Алгоритм решения будет иметь вид:
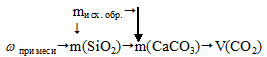
1. Определим массу примеси (SiO2) в исходном образце.
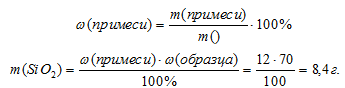
2. Определим массу карбоната кальция в образце.
m(СаСО3) = mисх. обр. – mприм. = 70 – 8,4 = 61,6 г.
3. По уравнению реакции определяем объем (н.у.) выделившегося газа.
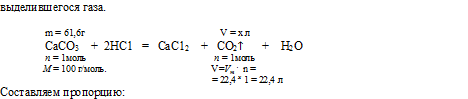
Составляем пропорцию:
из 61 ,6 г СаСО3 выделяется х л СО2 (по данным условия);
из 100 г СаСО3 выделяется 22,4 л СО2 (по уравнению);
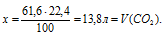
Ответ: Объем СО2 равен 13,8 л (н.у.).
Задача 1.2
Образец углерода, содержащий некоторое количество негорючей примеси, сожгли в избытке кислорода. В результате реакции получили 67,2 л углекислого газа (н.у.). Определите содержание (массовую долю) примеси в образце, если его масса составляла 40 г.
Дано:
масса исходного образца: mисх. обр. = 40 г;
объем (н.у.) выделившегося углекислого газа: V(СО2) = 67,2 л.
Найти:
массовую долю примеси:  оприм. = ?
оприм. = ?
Решение:
В условии сказано, что примесь является негорючей, следовательно, углекислый газ образуется только в результате сгорания углерода:
С + О2 = СО2.
Алгоритм решения можно представить следующим образом:
V(СO2) → m(С) → (С)в исх. обр. →  прим.
прим.
1. По уравнению реакции определим массу чистого углерода.
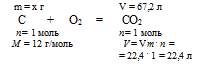
Составим пропорцию:
x г углерода дают 67,2л СО2 (по данным условия);
12 г углерода дают 22,4л СО2 (по уравнению реакции);
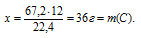
2. Определяем массовую долю углерода в образце.
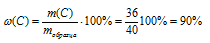
3. Определяем массовую долю примеси в образце.
 прим. = 100% – (С) = 100% – 90% -=10% .
прим. = 100% – (С) = 100% – 90% -=10% .
Ответ: массовая доля негорючих примесей составляет 10%.

