Алгоритм решения задач на приготовление растворов с использованием кристаллогидратов
Кристаллогидраты — это твердые вещества, содержащие в своем составе воду, входящую в состав кристалла в виде целых молекул. Формулу кристаллогидрата записывают, указывая количество молекул кристаллизационной воды, приходящейся на одну единицу вещества. Например, СuSО4 . 5Н2О кристаллогидрат сульфата меди2; Nа2SО4 . 10Н2О — кристаллогидрат сульфата натрия (декагидрат сульфата натрия)3. Некоторые вещества могут образовывать несколько кристаллогидратов. Например:
СоСl2 . 6Н2О — розово-красные кристаллы (устойчив до t = 49 °С);
СоСl2 . 4Н2О — красные кристаллы (устойчив до t = 58 °С);
СоСl2 . 2Н2О — сине-фиолетовые кристаллы (устойчив до t = 90 °С);
СоСl2 . Н2О — темно-синие кристаллы (устойчив до t = 140 °С);
СоСl2 (безводн.) — бледно-синего цвета (устойчив до t плавл.= 724 °С).
Причем содержание воды в них зависит не только от влажности окружающей среды, но и от температуры. При ее повышении кристаллогидраты часто теряют воду, даже находясь, в равновесии с ней (под слоем воды). Так для хлорида кобальта приведены температуры, выше которых данный кристаллогидрат теряет воду.
При растворении кристаллогидрата образуется самый обычный раствор, где растворенным веществом будет безводная соль, а кристаллизационная вода смешается с водой раствора.
При решении задач с использованием кристаллогидратов следует учитывать кристаллизационную воду, поступающую в раствор.
Задача 1.
Определить массу медного купороса СuSО4 . 5Н2О, который необходимо добавить к 300 г 2%-ного (масс.) раствора СuSО4 в воде для получения 5% -ного раствора.
Дано:
масса исходного раствора: mисх р-ра = 300 г;
массовая доля СuSО4 в исходном р-ре: (СuSО4)в исх р.ре = 2%;
(СuSО4)в исх р.ре = 2%;
массовая доля СuSО4 в конечном р-ре:  (СuSО4)в кон р.ре = 5%.
(СuSО4)в кон р.ре = 5%.
Найти:
массу добавленного кристаллогидрата: m(СuSО4 . 5Н2О)довавл. = ?
Решение:
Отобразим условие задачи в виде рисунка:
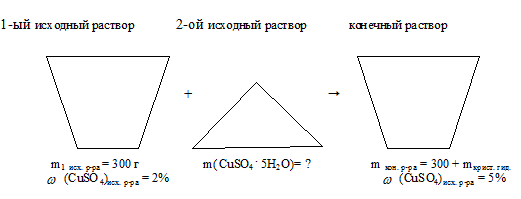
Алгоритм решения будет выглядеть следующим образом:
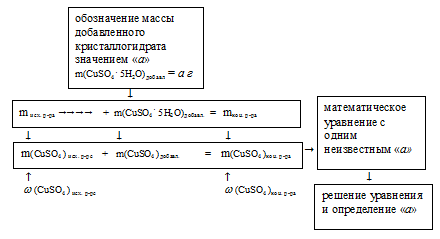
1. Искомой величиной является масса кристаллогидрата СuSО4 . 5Н2О. Обозначим ее величиной «а». Тогда масса полученного раствора составляет:
mкон. р-ра = mисх. р-ра + mкрист. гид. = (300 + а)
2. Так как кристаллогидрат состоит не из чистой соли, определим массу СuSО4
в «а» г СuSО4 . 5Н2О. Удобнее всего это сделать, используя молярную массу кристаллогидрата.
М(СuSО4 . 5Н2О) = (СuSО4) + 5 .М(Н2О) =
= 64 + 32 + 4 х 16 + 5 х ( 2 х 1 + 16) =
= 160 + 90 = 250 г/моль.
Составляем пропорцию:
250 г СuSО4 . 5Н2О содержит 160 г СuSО4 (по молярной массе);
а mСuSО4 . 5Н2О содержит х г СuSО4 (по условию);
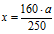 (масса чистого СuSО4 в а г кристаллогидрата).
(масса чистого СuSО4 в а г кристаллогидрата).
3. Теперь определим массу чистого СuSО4 в исходном и конечном растворах.
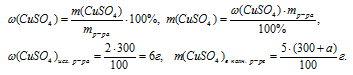
Масса чистого СuSО4 в полученном растворе складывалась из суммы масс СuSО4 в исходном растворе и чистого СuSО4 в кристаллогидрате. Отсюда имеем математическое уравнение:
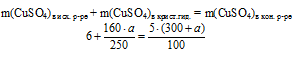
Решая это уравнение, получим: а = 15 г.
Величиной «а» мы обозначали массу кристаллогидрата.
m(СuSО4 . 5Н2О) = 15г.
Ответ: необходимо добавить 15 г СuSО4 . 5Н2О.
Комментарии:
1 При приготовлении растворов часто приходится использовать не чистые вещества, а их кристаллогидраты.
2 Бытовое и промышленное название — медный купорос.
3 Бытовое и промышленное название — глауберова соль.

