Способы определения молекулярной формулы соли, если известна степень окисления металла
Задача 114.
В 20 г сульфата некоторого металла содержится 4,5 г атомов серы. Определите формулу соли, если известно, что металл проявляет в этом соединении степень окисления (+1).
Дано: масса образца сульфата некоторого металла: m(соли) = 20 г; масса серы в образце: m(S) = 4,5 г; степень окисления неизвестного металла: +1.
Найти: формулу сульфата.
Решение:
Для идентификации металла необходимо определить его молярную массу. Здесь возможны 2 способа решения.
I способ (последовательно-разветвленный алгоритм).
Схематично алгоритм данного способа можно записать следующим образом:
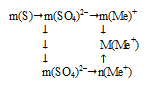
Применим предложенный алгоритм.
1) m(S) → m(SО4)2–
По степени окисления металла в сульфате определяем общую формулу искомого вещества Ме2+(SO4)2–. В кислотном остатке серной кислоты (SО4)2– соотношение атомов строго определено уже известными индексами. Поэтому мы легко сможем определить массу кислотного остатка в 20 г сульфата металла по массе серы:
М(SО4)2– = М(S) . 1 + М(О) . 4 =
= 32 . 1 + 16 . 4 = 96 г/моль.
Масса 1 моль кислотного остатка (SО4)2– составляет 96 г1.
Составим пропорцию:
вклад серы в 96 г ионов (SО4)2– составляет 32 г (по молярной массе)
вклад серы в х г ионов (SО4)2– составляет 4,5 г (по условию)
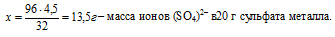
2) m(SО4)2– → n(SО4)2–
Находим количество вещества ионов (SО4)2–
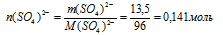
3) n(SО4)2– → n(Me+)
Находим количество вещества ионов Ме+, соответствующее содержанию ионов кислотного остатка n(SО4)2– = 0,141 моль. Используя формулу Ме2+(SО4)2–, составим пропорцию:
на 2 моль ионов Ме+ приходится 1 моль ионов (SО4)2– (по индексам в формуле)
на х моль ионов Ме+, приходится 0,141 моль ионов (SО4)2– (по условию)
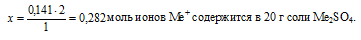
4) m(SО4)2– → m(Me)+
Находим массу металла в 20 г соли Ме2SО4.
m(Ме+) = m Ме2+(SО4)2– – m(SО4)2– = 20 – 13,5 = 6,5 г.
5) Находим молярную массу атомов металла
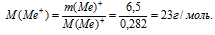
В данном случае молярную массу ионов металла можно приравнять к молярной массе незаряженных атомов:
М(Ме+) = М(Ме) = 23 г/моль.
По таблице Д.И. Менделеева находим элемент, имеющий молярную массу 23г/моль. Подходит натрий. Этот элемент действительно проявляет степень окисления (+1) и образует сульфат Nа2SО4.
II способ (встречный алгоритм).
Схематично алгоритм данного способа можно записать следующим образом:
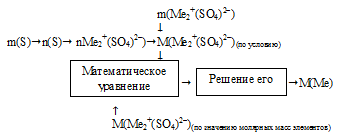
Применим данный алгоритм.
1) По степени окисления металла в сульфате определяем общую формулу искомого вещества Ме2+(SО4)2–
2) По массе серы в образце определяем ее количество вещества:
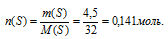
3) По записи формулы сульфата Ме2+моль ионов Ме+ содержится в 20 г соли Ме2SO4 видно, что количество вещества серы равно количеству вещества соли:
n(S) = nМе2+(SО4)2– = 0,141 моль.
4) По значениям количества вещества и массы образца сульфата определяем значение молярной массы соли:
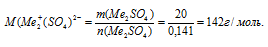
5) Записываем выражение для определения молярной массы для сульфата металла, исходя из значений молярных масс элементов:
М(Ме2+(SО4)2–) = М(Ме) . 2 + М(S) . 1 + М(О) . 4 =
= М(Ме) . 2 + 32 . 1 + 16 . 4 = [М(Ме) . 2 + 96] г/моль.
6) Приравниваем полученное выражение к значению молярной массы соли, полученному в четвертом действии:
М(Ме) . 2 + 96 = 142.
Получили одно математическое уравнение с одним неизвестным. Его решение дает нам молярную массу искомого металла: М(Ме) = 23 г/моль.
По таблице Д. И. Менделеева находим элемент, имеющий молярную массу 23 г/моль. Подходит натрий. Этот элемент действительно проявляет степень окисления (+1) и образует сульфат Nа2SО4.
III способ (встречный алгоритм).
Графический алгоритм данного способа будет следующим:
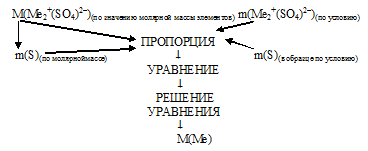
Применим данный алгоритм.
1) По степени окисления металла в сульфате определяем общую формулу искомого вещества Ме2+(SО4)2–. Записываем значение молярной массы для этого вещества:
М(Ме2+(SО4)2–) = М(Ме) . 2 + М(S) . 1 + М(О) .4 =
= М(Ме) . 2 + 32 . 1 + 64 . 4 = (М(Ме) . 2 + 96) г/моль.
Вклад серы в общую массу 1 моль Ме2+(SО4)2– составляет:
М(S) . 1 = 32 . 1 = 32 г.
Выбираем в качестве образца массу 1 моль Ме2+(SО4)2–:
M(Ме2+(SО4)2–) = (М(Ме) . 2 + 96) г.
Масса серы в этом выбранном образце: m(S) = 32 г.
2) Составляем пропорцию:
(М(Ме) . 2 + 96) г Ме2+(SО4)2– содержит 32 г (S) (по молярной массе);
20 г Ме2+(SО4)2– содержит 4,5 г (S) (по условию).
3) Из пропорции получаем уравнение с одним неизвестным:
(M(Ме) . 2 + 96) . 4,5 = 20 . 32
4) Решая уравнение, получаем значение молярной массы искомого металла:
М(Ме) = 23,1 г/моль.
По таблице Д.И. Менделеева находим элемент, имеющий молярную массу 23,1 г/моль. Подходит натрий. Этот элемент действительно проявляет степень окисления (+1) и образует сульфат Nа2SО4.
Ответ: Nа2SО4.
Последовательно-разветвленный алгоритм в решении задач по химии:
1. Определение формулы оксида
2. Задача № 158
Комментарии:
1 Молярную массу любых ионов можно считать точно так, как и молярную массу нейтральных частиц. Молярная масса любого иона отличается от молярной массы такой же незаряженной частицы на массу нескольких электронов. Если заряд иона «+n», то М(иона) < М(незаряженной частицы) на массу n электронов, если заряд иона «-n», то M(иона) > М(незаряженной частицы) на массу n электронов. Так как масса электрона значительно меньше (в 1840 раз) массы даже самого легкого атома водорода, не говоря уже о более тяжелых атомах других металлов, то массой электронов при подсчете молярной массы можно пренебречь и считать условно, что M(иона) = М(незаряженной частицы).

