Определение молекулярной формулы соли, если степень окисления металла в ней (+2)
Задача 113.
Молярная масса фосфата некоторого металла составляет 262,9 г/моль. Определите формулу (der Formel) этой соли, если степень окисления металла в ней (+2).
Дано: молярная масса фосфата металла: М(соли) = 262,9 г/моль;
степень окисления металла: «+2».
Найти: формулу соли.
Решение:
По степени окисления металла и заряду иона кислотного остатка фосфорной кислоты определяем общую формулу: Ме3+2(РО4)2–3.
Встречный алгоритм решения схематично можно представить таким образом:
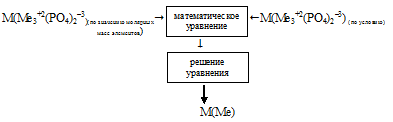
1. Записываем выражение для молярной массы М(Ме3+2(РО4)2–3), пользуясь значениями молярных масс, элементов из Периодической системы:
М(Ме3+2(РО4)2–3) =
= М(Ме) . 3 + М(Р) . 2 + М(О) . 4 . 2 =
= М(Ме) . 3 + 31 . 2 + 16 . 4 . 2 =
= М(Ме) . 3 +190 г/моль.
2. Приравниваем полученное выражение к значению молярной массы Ме3+2(РО4)2–3 из условия:
М(Ме) . 3 +190 = 262,9
Получили уравнение с одним неизвестным.
3. Решая его, находим значение молярной массы искомого металла: М(Ме) = 24,3 г/моль.
По таблице Д.И. Менделеева находим элемент, имеющий молярную массу 24,3 г/моль. Подходит магний. Этот элемент действительно проявляет степень окисления (+2) и образует фосфат Мg3(РО4)2.
Ответ: Мg3(РО4)2.

