Правильное составление формул веществ. Степень окисления. Периодическая система элементов
Задание 54.
Какую низшую степень окисления проявляют водород, фтор, сера и азот? Почему? Составьте формулы соединений кальция с данными элементами в этой степени окисления. Как называются соответствующие соединения?
Решение:
Низшая степень окисления определяется тем условным зарядом, который приобретает атом при присоединении того числа электронов, которое необходимо для образования устойчивой электронной оболочки инертного газа ns2np6 (в случае с водородом ns2). Водород, фтор, сера и азот находятся соответственно в IА-, VIIА-, VIА- и VА- группах периодической системы химических элементов и имеют структуру внешнего энергетического уровня s1, s2p5, s2p4 и s2p3.
Таким образом, для завершения внешнего энергетического уровня, атому водорода и атому фтора необходимо присоединить по одному электрону, атому серы – два, атому азота – три. Отсюда низкая степень окисления для водорода, фтора, серы и азота равна соответственно -1, -1, -2 и -3. Формулы соединений кальция с данными элементами в этой степени окисления:
CaH2 – гидрид кальция;
CaF2 – фторид кальция;
CaS – сульфид кальция;
Ca3N2 – нитрид кальция.
Задание 55.
Какую низшую и высшую степени окисления проявляют кремний, мышьяк, селен и хлор? Почему? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления.
Решение:
Высшую степень окисления элемента определяет, как правило, номер группы периодической системы
Д. И. Менделеева, в которой он находится. Низшая степень окисления определяется тем условным зарядом, который приобретает атом при присоединении того числа электронов, которое необходимо для образования устойчивой восьмиэлектронной оболочки инертного газа ns2np6 (в случае с водородом ns2). Кремний, мышьяк, селен и хлор находятся соответственно в IVА-, VА-, VIа- и VIIА- группах и имеют структуру внешнего энергетического уровня соответственно s2p2, s2p3, s2p4 и s2p5. Таким образом, высшая степень окисления кремния мышьяка, селена и хлора равна соответственно +4, +5, +6 и +7. Формулы соединений данных элементов, отвечающих этим степеням окисления: H2SiO3 – кремневая кислота; Н3AsO4 – мышьяковая кислота; H2SeO4 – селеновая кислота; HClO4 – хлорная кислота.
Низшая степень окисления кремния мышьяка, селена и хлора равна соответственно -4, -5, -6 и -7. Формулы соединений данных элементов, отвечающих этим степеням окисления: H4Si, H3As, H2Se, HCl.
Задание 56.
Хром образует соединения, в которых он проявляет степени окисления +2, +3, +6. Составьте формулы его оксидов и гидроксидов, отвечающих этим степеням окисления. Напишите уравнения реакций, доказывающих амфотерность гидроксида хрома (III).
Решение:
Хром образует соединения, в которых проявляет степени окисления +2, +3, +6. Формулы его оксидов и гидроксидов, отвечающих этим степеням окисления:
а) оксиды хрома:
CrO – оксид хрома (II);
Cr2O3 – оксид хрома (III);
CrO3 - оксид хрома (VI).
б) гидроксиды хрома:
Cr(OH)2 – гидроксид хрома (II);
Cr(OH)3 – гидроксид хрома (III);
H2CrO4 – хромовая кислота.
Cr(OH)3 – гидроксид хрома (III) – амфолит, т. е. вещество, которое реагирует как с кислотами, так и с основаниями. Уравнения реакций, доказывающих амфотерность гидроксида хрома (III):
а) Cr(OH)3 + 3HCl = CrCl3 + 3H2O;
б) Cr(OH)3 + 3NaOH = NaCrO3 + 3H2O.
Задание 57.
Атомные массы элементов в периодической системе непрерывно увеличиваются, тогда, как свойства простых тел изменяются периодически. Чем это можно объяснить? Дайте мотивированный ответ.
Решение:
В большинстве случаев с возрастанием заряда ядра атомов элементов закономерно увеличиваются их относительные атомные массы, потому что происходит закономерное увеличение содержания протонов и нейтронов в ядрах атомов. Свойства простых тел изменяются периодически, потому что на наружном энергетическом уровне у атомов периодически изменяется количество электронов. У атомов элементов периодически с возрастанием заряда ядра возрастает число электронов на внешнем энергетическом уровне, которое необходимо для образования устойчивой восьмиэлектронной оболочки (оболочки инертного газа). Например, периодическая повторяемость свойств у атомов Li, Na и K объясняется тем, что на наружном энергетическом уровне их атомов имеется по одному валентному электрону. Также периодически повторяются свойства у атомов Не, Ne, Ar, Kr, Xe и Rn – у атомов этих элементов на наружном энергетическом уровне содержится по восемь электронов (у гелия – два электрона) – все они являются химически инертными, так как их атомы не могут ни присоединять, ни отдавать электроны атомам других элементов.
Задание 58.
Какова современная формулировка периодического закона? Объясните, по-чему в периодической системе элементов аргон, кобальт, теллур и торий помещены соответственно перед калием, никелем, иодом и протактинием, хотя и имеют большую атомную массу?
Решение:
Современная формулировка периодического закона: «Свойства химических элементов и образуемых ими простых или сложных веществ находятся в периодической зависимости от величины заряда ядра атомов элементов».
Так как у атомов К, Ni, I, Pa - обладающих меньшей относительной массой, чем соответственно у Ar, Co, Te, Th – заряды атомных ядер на единицу больше
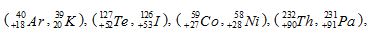
то калию, никелю, йоду и протактинию присваивается порядковые номера соответственно 19, 28, 53 и 91.Таким образом элементу в периодической системе присваивается порядковый номер не по возрастанию его атомной массы, а по количеству протонов, содержащихся в ядре данного атома, т. е. по заряду ядра атома. Номер элемента указывает заряд ядра (количество протонов, содержащихся в ядре атома), общее число электронов, содержащихся в данном атоме.
Задание 59.
Какую низшую и высшую степени окисления проявляют углерод, фосфор, сера и йод? Почему? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления.
Решение:
Высшую степень окисления элемента определяет, как правило, номер группы периодической системы Д. И. Менделеева, в которой он находится. Низшая степень окисления определяется тем условным зарядом, который приобретает атом при присоединении того числа электронов, которое необходимо для образования устойчивой восьмиэлектронной оболочки инертного газа ns2np6 (в случае с водородом ns2). Углерод, фосфор, сера и йод находятся соответственно в IVА-, VА-, VIа- и VIIА- группах и имеют структуру внешнего энергетического уровня соответственно s2p2, s2p3, s2p4 и s2p5. Таким образом, высшая степень окисления углерода, фосфора, серы и йода равна соответственно +4, +5, +6 и +7. Формулы соединений данных элементов, отвечающих этим степеням окисления: СО2 – оксид углерода (II); Н3РO4 – ортофосфорная кислота; H2SO4 – серная кислота; HIO4 – йодная кислота.
Низшая степень окисления углерода, фосфора, серы и йода равна соответственно -4, -5, -6 и -7. Формулы соединений данных элементов, отвечающих этим степеням окисления: СH4, H3Р, H2S, HI.
Задание 60.
Атомы каких элементов четвертого периода периодической системы образуют оксид, отвечающий их высшей степени окисления Э2О5? Какой из них дает газообразное соединение с водородом? Составьте формулы кислот, отвечающих этим оксидам и изобразите их графически?
Решение:
Оксид Э2О5, где элемент находится в своей высшей степени окисления +5, характерен для элементов V группы. Такой оксид могут образовывать два элемента четвёртого периода и V- группы – это элемент №23 (ванадий) и №33 (мышьяк). Ванадий и мышьяк, как элементы пятой группы, образуют водородные соединения состава ЭН3, потому что они могут проявлять низшую степень окисления -3. Так как мышьяк – неметалл, то он образует с водородом газообразное соединение – H3As – арсин.
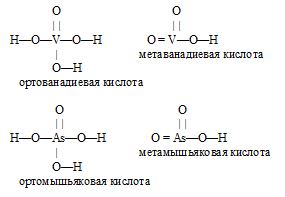
Формулы кислот, отвечающих оксидам в высшей степени окисления ванадия и мышьяка:
H3VO4 – ортованадиевая кислота;
HVO3 – метаванадиевая кислота;
HAsO3 – метамышьяковая кислота;
H3AsO4 – мышьяковая (ортомышьяковая) кислота.
Графические формулы кислот: