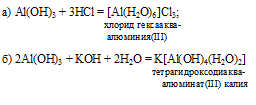Составление формул веществ. Степень окисления. Электроотрицательность.
Периодическая система элементов
Задание 41.
Исходя из положения германия и технеция в периодической системе, составьте формулы мета- и ортогерманиевой кислот, и оксида технеция, отвечающие высшей степени окисления. Изобразите формулы этих соединений, графически.
Решение:
Высшую степень окисления элемента определяет, как правило, номер группы периодической системы Д. И. Менделеева, в которой он находится. Германий и технеций находятся соответственно в IV и VII. Структура внешнего энергетического уровня германия 4s24p2, технеция 4d55s2, поэтому их оксиды с высшей степенью окисления соответственно имеют формулы GeO2, Te2O7.
а) GeO2 – оксид германия (IV) является ангидридом ряда германиевых кислот, состав которых можно выразить общей формулой хGeO2 . yH2O, где х и у – целые числа:
1) х = 1, у = 1: GeO2 . Н2О или Н2GeO3 – метагерманиевая кислота, структурную формулу которой можно представить так:
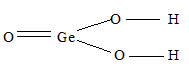
2) х = 1, у = 2: GeO2. 2Н2О или Н4GeO4 – ортогерманиевая кислота, структурную формулу которой можно представить так:
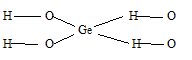
б) Формула оксида технеция (VII) имеет вид: Te2O7. Структурная формула Te2O7:
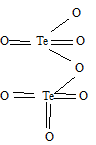
Задание 42.
Что такое энергия ионизации? В каких единицах она выражается? Как изменяется восстановительная активность s- и р-элементов в группах периодической системы с увеличением порядкового номера? Почему?
Решение:
Энергия ионизации (I) – это энергия, необходимая для отрыва электрона от атома. Она измеряется в кДж/моль.
Поскольку при движении вниз по группам размеры атомов увеличиваются, внешние электроны находятся дальше от ядра, и энергия ионизации уменьшается, т. е. электроны будут легче отрываться (теряться) и, поэтому с увеличением порядкового номера s- и р-элементов в группах периодической системы восстановительные свойства будут увеличиваться. Все s-элементы – металлы, которые являются восстановителями, т. е. они всегда отдают электроны. Высокая их восстановительная способность проявляется в реакции их с водой, это касается металлов. У р-элементов с увеличением порядкового номера в группах периодической системы закономерно увеличиваются радиусы атомов, что приводит к закономерному увеличению восстановительных свойств. Например, эле-менты VII группы: F, Cl, Br, I. Электроотрицательность их закономерно уменьшается сверху вниз, т. е. наименьшей способностью отдавать электроны обладает фтор, наименьшей – йод. Так же закономерно уменьшаются стандартные электродные потенциалы.
Таким образом, у s- и р-элементов в группах восстановительная способность, т. е. способность элементов отдавать электроны закономерно увеличивается, а присоединять – уменьшается с возрастанием порядкового номера элемента. Связано это с увеличением заряда ядра атома и его радиуса.
Задание 43.
Что такое электроотрицательность? Как изменяется электроотрицательность р-элементов в периоде, в группе периодической системы с увеличением порядкового номера? Почему?
Решение:
Электроотрицательность – это способность атома притягивать к себе электроны других атомов. Электроотрицательность не может быть выражена, измерена в единицах каких-либо физических единиц, поэтому для количественного определения электроотрицательности (ЭО) предложена шкала Полинга, по которой ЭО фтора принята равной 4,0.
Шкала ЭО Полинга в общих чертах напоминает периодическую систему Менделеева. Электроотрицательность р-элементов в периодах с увеличением порядкового номера элемента закономерно увеличивается, например от В к F соответственно 2,0 (В) и 4,0 (F). Объясняется это тем, что с ростом порядкового номера увеличивается заряд ядра атома, возрастает число электронов, всё это приводит к увеличению электростатического взаимодействия ядра и электронов, которое приводит к уменьшению размеров внешних орбиталей. В группах электроотрицательность элементов уменьшается сверху вниз. Объясняется это тем, что радиусы атомов с ростом порядкового номера элемента в подгруппе всегда увеличиваются из-за того, что с ростом номера элемента в подгруппе всегда увеличивается число экранирующих подуровней остова атома.
Задача 44.
Исходя из положения германия, молибдена и рения в периодической системе, составьте формулы водородного соединения германия, оксида молибдена и рениевой кислоты, отвечающие их высшей степени окисления. Изобразите формулы этих соединений графически.
Решение:
Высшую степень окисления элемента определяет, как правило, номер группы периодической системы Д. И. Менделеева, в которой он находится.
Германий, молибден и рений находятся соответственно в IVА-, VIВ- и VIIВ группах и имеют структуру внешнего энергетического уровня 4s24p2; 4d55s4 и 5d56s2. Высшая валентность германия равна 4, поэтому формула водородного соединения имеет вид: GeH4, а структурная формула будет иметь вид:
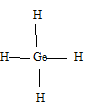
Высшая валентность молибдена равна 6. Формула оксида молибдена (VI) имеет вид: МоО3, структурная формула будет иметь вид:
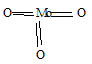
Высшая валентность рения равна 7. Формула рениевой кислоты имеет вид: НReO4. Структурная формула имеет вид:
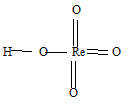
Задание 45.
Что такое сродство к электрону? В каких единицах оно измеряется? Как изменяется окислительная активность неметаллов в периоде и в группе периодической системы с увеличением порядкового номера? Ответ мотивируйте строением атома соответствующего элемента.
Решение:
Сродство к электрону – это энтальпия, поглощаемая 1 моль электронов для появления ионов данного элемента. Сродство к электрону измеряется в кДж/моль. Окислительная активность неметаллов (способность принимать электроны) в группе с увеличением по-рядкового номера элементов уменьшается, потому что с ростом заряда элемента растёт и радиус атома. Всё это приводит к уменьшению сродства к электрону у атомов элементов данной группы. Например, атомы фтора и хлора соответственно имеют следующие электронные конфигурации (Не)2s22p5 (r = 0,072 нм) и (Ne)3s23p5 (r = 0,099 нм). Атому фтора будет легче присоединять электрон, чем атому хлора.
В периодах окислительная активность неметаллов будет увеличиваться с увеличением порядкового номера элемента, так как будет уменьшаться радиус атомов с увеличением заряда ядра. Например, атом серы и хлора имеет следующие электронные конфигурации (Ne)3s23p4; (Ne)3s23p5. Имея семь электронов на внешнем энергетическом уровне, больше на один, чем атом серы и, соответственно больший радиус заряд ядра, чем у атома серы. Поэтому атом хлора будет иметь меньший размер атома (r = 0,099 нм), чем атом серы (r = 0,104 нм). Исходя из этого, атом хлора будет легче присоединять электроны, чем атом серы, т. е. хлор будет проявлять окислительные способности, чем сера.
Задание 46.
Составьте формулы оксидов и гидроксидов элементов третьего периода периодической системы, отвечающих их высшей степени окисления. Как изменяется кислотно-основный характер этих соединений при переходе от натрия к хлору? Напишите уравнения реакций, доказывающих амфотерность гидроксида алюминия.
Решение:
Формулы оксидов и гидроксидов элементов третьего периода периодической системы, отвечающих их высшей степени окисления имеют вид:
N2O – оксид натрия; NaOH – гидроксид натрия;
MgO – оксид магния; Mg(OH)2 – гидроксид магния;
Al2O3 – оксид алюминия; Al(OH)3 – гидроксид алюминия;
SiO2 –оксид кремния (IV); H2SiO3 – кремневая кислота;
P2O5 – оксид фосфора (V); H3PO4 – ортофосфорная кислота;
SO3 – оксид серы (VI); H2SO4 – серная кислота;
Cl2O7 – оксид хлора (VII); HClO4 – хлорная кислота.
Основные свойства гидроксидов при переходе от натрия к хлору ослабевают, а кислотные – усиливаются. Это связано с тем, что в периоде с увеличением порядкового номера радиусы атомов элементов и их ионов закономерно уменьшаются, наблюдается увеличение эффективного заряда атома, увеличение электроотрицательности элемента.
Гидроксид алюминия проявляет как и сам элемент, амфотерные свойства, т. е. он способен реагировать как с кислотами, так и с основаниями: