В каких соединениях химическая связь имеет более ковалентный характер
Задача 993.
Закончить уравнения реакций:
а) Au(OH)3 + HCl (конц.) →
б) AuCl3 + H2O2 + KOH →
в) AuCl3 + SnCl2 + H2O →
г) Au + NaCN + O2 + H2O →
д) Au + HCl + HNO3 → H[AuCl4] +
Решение:
а) Au(OH)3 + 3HCl (конц.) →
→ AuCl3 + 3H2O;
б) AuCl3 + H2O2 + 2KOH →
→ AuCl + 2KCl + O2↑ + 2H2O;
в) AuCl3 + SnCl2 + H2O →
→ H[AuCl4] + SnOHCl;
г) Au + 8NaCN + O2 + 2H2O →
→ 4Na[Au(CN)2] + 4NaOH;
д) Au + 4HCl + HNO3 →
→ H[AuCl4] + NO↑ + 2H2O.
Задача 994.
В каком из соединений — КСI или АgС1 — химическая связь имеет более ковалентный характер? Чем это можно объяснить?
Решение:
Относительная электроотрицательность элементов K, Ag и Cl соответственно равны 0,93, 1,46 и 2,9. Разность электроотрицательностей элементов в связях К — Cl и Ag — Cl соответственно равны 1,97 (2,9 – 0,93 = 1,97) и 1,44 (2,9 – 1,46 = 1,44). Таким образом, связь
Ag — Cl более ковалентна, чем связь К — Cl, так как 1,44 < 1,97.
Задача 995.
Кусочек серебряной монеты массой 0,300 г растворили в азотной кислоте и осадили из полученного раствора серебро в виде АgС1. Масса осадка после промывания и высушивания оказалась равной 0,199 г. Сколько процентов серебра (по массе) содержалось в монете?
Решение:
Уравнения реакций имеют вид:
Ag + 2HNO3 = AgNO3 + NO2 + H2O;
AgNO3 + HCl = AgCl↓ + HNO3
Согласно закону эквивалентов вещества реагируют друг с другом в эквивалентных отношениях, поэтому:
(Ag) = (AgNO3) = (AgCl).
Рассчитаем массу серебра:
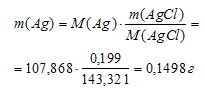
Рассчитаем массовую долю серебра в образце:
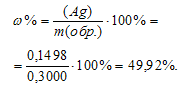
Ответ: 49,92%.

