Вычислдение массовой доли меди, олова и цинка в анализируемой пробе латуни
Состав латуни
Задача 996.
Из навески латуни массой 1,6645 г при анализе получено 1,3466 г Сu(SCN)2 и 0,0840 г SnO2. Вычислить массовую долю меди, олова и цинка в анализируемой пробе.
Решение:
М[Сu(SCN)2] = 179,7 г/моль;
М(SnO2) = 150,69 г/моль; М(Cu) = 63,5 г/моль;
M(Sn) = 118,69 г/моль.
Вычислим массовые доли меди и олова в Сu(SCN)2 и SnO2, получим:
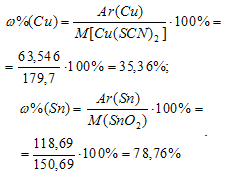
Находим массы меди, олова и цинка в пробе:
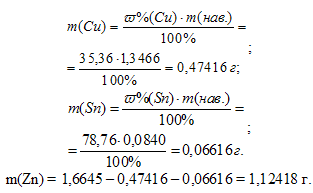
Теперь вычислим массовые доли меди, олова и цинка:
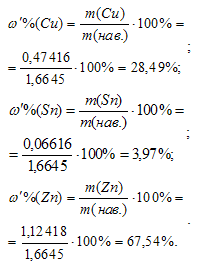
Ответ: 28,49% Cu; 3,97% Sn; 67,54% Zn.
Реакции раствора аммиака
Задача 997.
Какие из перечисленных соединений взаимодействуют с раствором аммиака: а) Сu(OH)2 б) АgCl; в) АgI?
Решение:
а) Сu(OH)2 растворяется в растворах аммиака с образованием комплексного катиона тетраамминмеди (II):
Сu(OH)2 +4NH3 → [Cu(NH3)4]2+ + 2OH-.
Таким образом, при взаимодействии Сu(OH)2 с аммиаком образуется комплексное соединение тёмно-синего увета, хорошо растворимое в воде [Cu(NH3)4](OH)2 – гидроксид тетраамминмеди (II).
б) АgCl – малорастворимое соединение, которое легко растворяется в водном растворе аммиака. Причина растворения АgCl в растворе аммиака заключается в образовании комплексных катионов [Ag(NH3)2]+:
АgCl + 2NH3 → [Ag(NH3)2]Cl.
В насыщенном растворе хлорида серебра устанавливается равновесие АgCl → Ag+ + Cl¯. Вводимые в раствор хлорида серебра молекулы NH3 связываются с ионами Ag+ в комплексные ионы [Ag(NH3)2]+.
в) АgI в отличие от AgCl в растворе аммиака не растворяется. Объясняется это тем, что ПР(АgI) = 4 . 10-17 и, отвечающая произведению растворимости концентрация ионов Ag+ намного меньше, чем то, что соответствует диссоциации, сравнительно нестойкого комплексного иона [Ag(NH3)2]+ (КН = 8,8 . 10-8),
т. е. [Ag+] < KН[Ag(NH3)2]+.
Реакция среды раствора карбоната калия
Задача 998.
Какова реакция среды в растворе карбоната калия: а) кислая; 6) нейтральная; в) щелочная?
Решение:
К2СО3 – соль сильного основания и слабой кислоты гидролизуется по аниону:
К2СО3 ↔ К+ + СО32-;
СО32- + Н2О ↔ НСО3¯ + ОН¯ (ионно-молекулярная форма);
К2СО3 + Н2О ↔ КНСО3 + КОН (молекулярная форма).
Гидролиз соли протекает практически только по первой ступени. При гидролизе образуется избыток ионов ОН-, которые придают раствору соли щелочную среду, рН > 7.
Ответ: в).

