Химические свойства концентрированной азотной кислоты
Реакции азотной кислоты
Задача 999.
С какими из перечисленных веществ взаимодействует концентрированная НNO3: а) NаОН; 6) СuО; в) Аg; г) КСI? При этом азотная кислота проявляет: 1) кислотные свойства; 2) окислительные свойства.
Решение:
а) Между концентрированной азотной кислотой и гидроксидом натрия произойдёт реакция нейтрализации:
HNO3 (конц.) + NaOH ↔ NaNO3 + H2O.
Здесь азотная кислота проявляет свойства кислоты.
б) Между концентрированной азотной кислотой и оксидом меди (II) произойдёт реакция:
2HNO3 (конц.) + CuO ↔ Cu(NO3)2 + H2O.
Здесь азотная кислота проявляет свойства кислоты.
в) Между концентрированной азотной кислотой и серебром произойдёт окислительно-восстановительная реакция:
Ag + 2HNO3 (конц.) ↔ AgNO3 + NO2↑ + H2O.
Здесь азотная кислота проявляет окислительные свойства.
г) При слиянии растворов концентрированной кислоты и хлорида калия реакция не произой2дёт, потому что, находящиеся в растворе ионы К+ и Cl− (KCl ↔ K+ + Cl−), а также ионы Н+ и NO3− (HNO3 ↔ H+ + NO3−) не будут связываться друг с другом с образованием осадка, газа или слабого электролита.
Ответ: а1); б1); в2).
Изомолярные растворы солей
Задача 1000.
Каково соотношение рН изомолярных растворов NаНSО3 (рH1) и Na2SO3 (рH2): а) рH1 > рH2; б) рH1 = рН2; в) рН1 < рН2?
Решение:
KD1(H2SO3) = 1,58 . 10-2;
KD2(H2SO3) = 6,31 . 10-8
NаНSОз – кислая соль слабой кислоты и сильного основания гидролизуется по аниону:
NаНSО3 ↔ Na+ + HSO3−;
HSO3− + H2O ↔ H2SO3 + OH−.
Na2SO3 – соль слабой кислоты и сильного основания гидролизуется по аниону:
Na2SO3 ↔ 2Na+ + SO32-;
I ступень: SO32- + H2O ↔ HSO3− +OH−;
II ступень: HSO3− + H2O ↔ H2SO3 + OH−.
Степень гидролиза определяется по формуле:
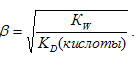
Так как Na2SO3 практически гидролизуется по первой ступени, то то константа гидролиза этой соли будет определяться второй константой диссоциации H2SO3, а соли NаНSО3 – первой константой диссоциации H2SO3. Поэтому константа гидролиза соли Na2SO3 будет больше, чем константа гидролиза соли NаНSО3. Следовательно, степень гидролиза соли NаНSО3 будет меньше, чем степень гидролиза соли Na2SO3 и, соответственно, концентрация ионов OH− в растворе соли NаНSО3 будет значительно меньше, чем в растворе соли Na2SO3, значит рН1 < pH2.
Ответ: в).

