Как правильно рассчитать рН изомолярного раствора
Задача 1104.
Каково соотношение рН изомолярных растворов Sn(NO3)2 (рH1) и Рb(NO3)2 (рН2): а) рH1 > рН2; б) рН1 = рН2; в) рH1 < рH2?
Решение:
ПР[Sn(ОН)2] = 6 . 10-26;
КД[Pb(ОН)2] = 9,6 . 10-4
а) Sn(NO3)2 – соль слабого основания [(Sn(OH)2] и сильной кислоты (HNO3), поэтому гидролизуется по катиону. С учетом того, что гидролиз в основном протекает по первой ступени, уравнение гидролиза можно представить уравнением:
Sn2+ + H2O → Sn(OH)+ + H+.
Следовательно, раствор соли Sn(NO3)2 имеет кислую реакцию среды (рН < 7), так как при гидролизе соли появляется избыток ионов Н+.
Рассчитаем растворимость Sn(ОН)2:
ПР[Sn(ОН)2] = [Sn2+] . [OH–] = S . (2S)2 = 4S3;
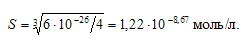
Константа гидролиза будет определяться растворимостью образовавшегося Sn(ОН)2 и определяется по формуле:
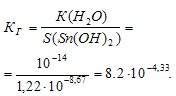
Степень гидролиза определяется по формуле:
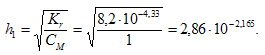
Теперь рассчитаем концентрацию образовавшихся ионов и рН:
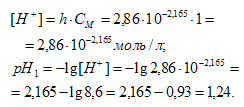
б) Рb(NO3)2 – соль слабого основания [(Sn(OH)2] и сильной кислоты (HNO3), поэтому гидролизуется по катиону. С учетом того, что гидролиз в основном протекает по первой ступени, уравнение гидролиза можно представить уравнением:
Sn2+ + H2O → Sn(OH)+ + H+
Следовательно, раствор соли Рb(NO3)2 имеет кислую реакцию среды (рН < 7), так как при гидролизе соли появляется избыток ионов Н+.
Константа гидролиза определяется константой диссоциации образовавшегося основания Сr(ОН)3 и определяется по формуле:
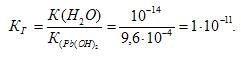
Степень гидролиза определяется по формуле:
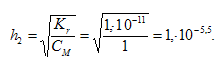
Теперь рассчитаем концентрацию образовавшихся ионов H+ и рН:
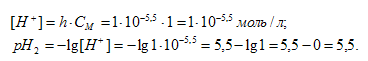
Таким образом, рH1 < рH2
Ответ: в.

