Решение расчётных задач по химии на вычисление произведения растворимости соли
Задача 559.
Растворимость СаСО3 при 35 °С равна 6,9 . 10-5 моль/л. Вычислить произведение растворимости этой соли.
Решение:
Уравнение диссоциации СаСО3 имеет вид:
СаСО3 ⇔ Са2+ + СО32-
При растворении каждого моля СаСО3 в раствор переходит 1 моль ионов Са2+ и 1 моль ионов СО32-. Следовательно, в насыщенном растворе СаСО3 содержится по 6,9 . 10-5 моль/л ионов Са2+ и СО32- (Са2+ = СО32-).
Отсюда находим произведение растворимости СаСО3:
ПР(СаСО3) = [Са2+] . [СО32-] =
= 6,9 . 10-5 . 6,9 . 10-5 = 4,76 . 10-9.
Ответ: 4,76 . 10-9.
Задача 560.
Вычислить произведение растворимости RbВг2 при 25 °С, если растворимость соли при этой температуре равна 1,32 . 10-2 молы/л.
Решение:
Уравнение диссоциации RbВг2 имеет вид:
RbBr2 ⇔ Rb2+ + 2Br-.
При растворении каждого моля RbВг2 в раствор переходит 1 моль ионов Rb2+ и 2 моль ионов Br-. Следовательно, в насыщенном растворе RbВг2 содержится по 1,32 . 10-2 моль/л ионов Rb2+ и (2 . 1,32 . 10-2) моль/л ионов Br-. Отсюда находим произведение растворимости RbВг2:
ПР(RbBr2) = [Rb2+] . [Br-]2 =
= 1,32 . 10-2 . (2 . 1,32 . 10-2)2 = 9,2 . 10-6.
Ответ: 9,2 . 10-6.
Задача 561.
В 500 мл воды при 18 °С растворяется 0,0166 г Ag2CrO4. Чему равно произведение растворимости этой соли?
Решение:
M(Ag2CrO4) = 332 г/моль.
Находим массу Ag2CrO4 в 1 л раствора из пропорции:
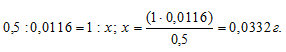
Рассчитаем молярную концентрацию раствора по формуле: 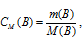 , получим:
, получим:
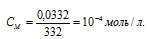
При растворении каждого моля Ag2CrO4 в раствор переходит 2 моля ионов Ag+ и 1 моль ионов CrO42-. Следовательно, в насыщенном растворе Ag2CrO4 концентрации ионов составляют:
[Ag+] = (2 . 1 . 10-4) моль/л;
[CrO42-] = 1 . 10-4 моль/л.
Отсюда
ПР(Ag2CrO4) = [Ag+]2 . [CrO42-] =
= (2 . 1 . 10-4)2 . 1 . 10-4 = 4 . 10-12.
Ответ: 4 . 10-12.
Задачи 562.
Для растворения 1,16 г PbI2 потребовалось 2 л воды. Найти произведение растворимости соли.
Решение:
M(PbI2) = 461,008 г/моль.
Находим массу PbI2 в 1 л раствора из пропорции:
2 : 1,16 = 1 : x;
x = (1 . 1,16)/2 = 0,58 г.
Рассчитаем молярную концентрацию насыщенного раствора по формуле 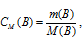 , получим:
, получим:
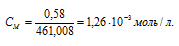
При растворении каждого моля PbI2 в раствор переходит 2 моля ионов I- и 1 моль ионов Pb2+. Следовательно, в насыщенном растворе PbI2 концентрации ионов составляют:
[I-] = (2 . 1,26 . 10-3) моль/л;
[Pb2+] = 1,26 . 10-3 моль/л.
Отсюда
ПР(PbI2) = [Pb2+] . [I-]2 =
= 1,26 . 10-3 . (2 . 1,26 . 10-3)2 = 8 . 10-9.
Ответ: 8 . 10-9.

