Решение задач по химии на вычисление растворимости солей
Задача 567.
Во сколько раз растворимость S (в молы/л) Fe(OH)2 в воде больше растворимости Fe(OH)3 при 25 °С?
Решение:
Вычислим сначала растворимость Fe(OH)2. Обозначим искомую растворимость Fe(OH)2 через S моль/л. Тогда в
насыщенном растворе Fe(OH)2 содержится 1 S моль/л ионов Fe2+ и 2 Sмоль/л ионов OH-.
Выражение произведения растворимости гидроксида железа (II) можно записать как
ПР[Fe(OH)2] = [Fe2+] . [OH-]2 =
= S . (2S)2 = 4S3.
Отсюда
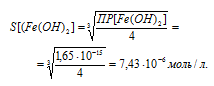
Теперь рассчитаем растворимость Fe(OH)3, обозначив её через S' моль/л. Тогда в насыщенном растворе Fe(OH)3 содержится S' моль/л ионов Fe3+ и 3S' моль/л ионов OH-.
Выражение произведения растворимости гидроксида железа (III) можно записать как
ПР[Fe(OH)3] = [Fe3+] . [OH-]3 =
= S . (3S)3 = 27S'4.
Отсюда
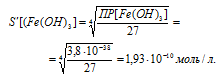
Следовательно, растворимость Fe(OH)2 в 38497 раз больше, чем растворимость Fe(OH)3.
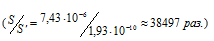
Ответ: в 38497 раз.
Задача 568.
Образуется ли осадок сульфата серебра, если к 0,02 М раствору AgNO3 добавить равный объем 1 н. раствора H2SO4?
Решение:
ПР[Ag2SO4] = 2 . 10-5.
При смешении растворов AgNO3 и H2SO4 происходит реакция, при которой образуется малорастворимое соединение Ag2SO4. Реакция протекает по схеме:
2AgNO3 + H2SO4 = Ag2SO4↓ + 2HNO3
При смешении растворов AgNO3 и H2SO4 объём смеси увеличится в 2 раза, следовательно, концентрации всех веществ уменьшатся в 2 раза и становятся равными:

Откуда
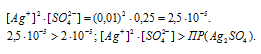
Так как произведение концентраций ионов больше величины произведения растворимости, то осадок соли образуется.
Ответ: Да.
Задача 569.
К 50 мл 0,001 н. раствора НСI добавили 450 мл 0,0001 н. раствора AgNO3. Выпадет ли осадок хлорида серебра?
Решение:
Уравнение реакции имеет вид:
HCl + AgNO3 = AgCl↓ + HNO3
Находим количество HCl в 50 мл 0,001 н раствора из пропорции:
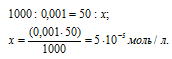
Теперь рассчитаем концентрацию HCl в 500 мл после разбавления водой раствора из пропорции:
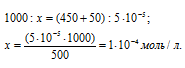
Рассчитаем количество AgNO3, содержащееся в 450 мл 0,0001 н раствора его из пропорции:
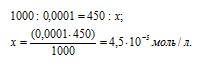
Теперь рассчитаем концентрацию AgNO3 в 500 мл после разбавления водой раствора из пропорции:
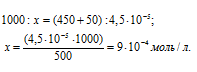
Таким образом, концентрации ионов Ag+ и Cl- в 1 л раствора, получим:
[Cl-] = [HCl] = 1 . 10-4 моль/л;
[Ag+] = [AgNO3] = 9 . 10-4 моль/л.
Откуда
[Ag+] . [Cl-] = (1 . 10-4) . (9 . 10-4) = 9 . 10-8
Осадок образуется так как [Ag+] . [Cl-] > ПР(AgCl); (9 . 10-4) > (1 . 10-4).
Ответ: Да.
Задача 570.
Образуется ли осадок хлорида свинца, если к 0,1 н. раствору Pb(NO3)2 добавить равный объем 0,4 н. раствора NaCl?
Решение:
ПР(PbCl2) = 2,12 . 10-5.
Уравнение реакции имеет вид:
Pb(NO3)2 + 2NaCl = PbCl2 + 2NaNO3;
CM(Pb(NO3)2) = 2CH(Pb(NO3)2) =
= 2 . 0,1 = 0,2 моль/л;
CM(NaCl) = CH(NaCl) = 0,4 моль/л.
При смешивании равных объёмов растворов Pb(NO3)2 и NaCl объём смеси увеличится в 2 раза, следовательно, концентрации веществ уменьшатся в 2 раза и становятся равными:
[Pb2+] =1/2 1/2[Pb(NO3)2] =
= 0,2/2 = 0,1 моль/л;
[Cl-] = 1/2[NaCl] = 0,4/2 = 0,2 моль/л.
Откуда
[Pb2+] . [Cl-]2 = 0,1 . (0,2)2 = 4 . 10-3.
Осадок образуется так как [Pb2+] . [Cl-]2 > ПР(PbCl2); = (4 . 10-3) > (2,12 . 10-5).
Ответ: Да.

