Вычисление приближенных значений коэффициентов активности ионов, ионное произведение воды
Задача 535.
Найти приближенные значения коэффициентов активности ионов Cl-, SO42-, PO43- и [Fe(CN)6]4- в растворе с ионной силой 0,0001.
Решение:
Активность концентрации иона в растворе электролита пропорциональна его концентрации CM, моль/л:  (ион) = fCM, где f - коэффициент активности иона.
(ион) = fCM, где f - коэффициент активности иона.
Значение коэффициента активности иона рассчитаем по формуле 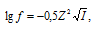 получим:
получим:
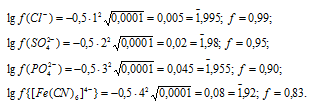
Ответ: f(Cl-) = 0,99; f(SO42-) = 0,95; f(PO43-) = 0,90; f{[Fe(CN)6]4-} = 0,83.
Задача 536.
Найти молярную концентрацию ионов H+ в водных растворах, в которых концентрация гидроксид-ионов (в моль/л) составляет: а) 10-4; б) 3,2 . 10-6; в) 7,4 . 10-11.
Решение:
Ионное произведение воды – это произведение концентрации ионов водорода и гидроксид-ионов, образующихся при диссоциации воды:
K(H2O) = [H+] . [OH-] = 10-14. .
Подставляя в это уравнение е данные задачи, рассчитаем молярную концентрацию ионов водорода, получим:
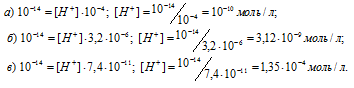
Ответ: а) 10-3 моль/л; б) 6,5 . 10-8 моль/л; в) 1,4 . 10-12 моль/л.
Задача 537.
Найти молярную концентрацию ионов OH- в водных растворах, в которых концентрация ионов водорода (в моль/л) равна: а) 10-3; б) 6,5 . 10-8; в) 1,4 . 10-12.
Решение:
Ионное произведение воды – это произведение концентрации ионов водорода и гидроксид-ионов, образующихся при диссоциации воды:
K(H2O) = [H+] . [OH-] = 10-14. .
Подставляя в это уравнение е данные задачи, рассчитаем молярную концентрацию ионов водорода, получим:
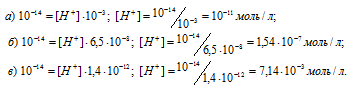
Ответ: а) 10-11 моль/л; б) 1,54 . 10-7 моль/л; в) 7,14 . 10-3 моль/л.

