Уравнения гидролиза и расчет константы и степени гидролиза соли
Молекулярная и ионная формы уравнений реакций гидролиза
Задача 21.
Напишите в молекулярной и ионной форме уравнения реакций гидролиза следующих солей: а) сульфида калия; б) сульфата меди (ⅠⅠ); в) совместного гидролиза хлорида алюминия и ацетата калия.
Решение:
а) Гидролиз сульфида калия
K2S - соль сильного одноосновного основания (КОН) и слабой духосновной кислоты (H2S) гидролизуется по аниону в две ступени:
Реакция диссоциации:
H2S = 2H+ + S2-.
1-я ступень гидролиза:
S2– + HOH = HS– + OH- (ионно-молекулярная форма);
K2S + H2O = KHS + KOH (молекулярная форма).
2-я ступень гидролиза:
HS– + HOH = H2S + OH- (ионно-молекулярная форма);
KHS+ H2O = H2S + KOH (молекулярная форма).
б) Гидролиз сульфата меди (ⅠⅠ)
CuSO4 - соль слабого двухосновного основания [Cu(ОН)2] и сильной двухосновной кислоты (H2SО4) гидролизуется по катиону в две ступени:
CuSO4 = Cu2+ + SO42- (уравнение диссоциации).
1-я ступень гидролиза:
Cu2+ + HOH = CuOH+ + H+ (ионно-молекулярная форма);
CuSO4 + H2O = CuOHSO4 + HSO4- (молекулярная форма).
2-я ступень гидролиза:
CuOH+ + HOH = Cu(OH)2 + H+ (ионно-молекулярная форма);
CuOHSO4 + H2O = Cu(OH)2 + H2SO4 (молекулярная форма).
в) Совместный гидролиз хлорида алюминия и ацетата калия
AlCl3 - соль слабого трехосновного основания [Al(ОН)3] и сильной односновной кислоты (HCl) гидролизуется по катиону, а CH3COOK - соль сильного одноосновного основания (КОН) и слабой одноосновной кислоты (СН3СООH) гидролизуется по аниону.
В таких случаях гидролиз взаимно усиливается, и, для каждой соли протекает практически до конца.
При гидролизе хлорида алюминия соль гидролизуется по катиону:
AlCl3 = Al3+ + 3Cl— (уравнение диссоциации);
Al3+ + 3HOH = Al(OH)3 + 3H+ (сокращенная ионно-молекулярная форма).
При гидролизе ацетата калия соль гидролизуется по аниону:
CH3COOK = К+ + CH3COO- (уравнение диссоциации);
CH3COO- + HOH = CH3COОН + OH- (сокращенная ионно-молекулярная форма).
При совместном гидролизе солей AlCl3 и CH3COOK, образовавшиеся ионы водорода (Н+) и гидроксид-ионы (ОН-) связываются в воду (Н+ + ОН- = Н2О), что, естественно, приводит к уменьшению их концентрации в растворе, а значит к усилению гидролиза этих солей. При этом будет происходить взаимное усиление гидролиза обеих солей, за счет смещения равновесия каждой из реакций вправо. Таким образом, гидролиз каждой соли пройдет до последней ступени.
Суммарная схема гидролиза:
Al3+ + 3CH3COO– + 3HOH = Al(OH)3↓ + 3CH3COOH
(сокращенная ионно-олекулярная форма);
Al3+ + 3Cl- + 3K+ + 3CH3COO– + 3HOH = Al(OH)3↓ + 3CH3COOH
(полная ионно-молекулярная форма);
AlCl3 + 3CH3COOK + 3H2O = Al(OH)3↓ + 3CH3COOH + 3KCl
(молекулярная форма).
Так как выделяющиеся при гидролизе хлорида алюминия ионы водорода связываются с гидроксид-ионами, выделяющимися при гидролизе ацетата калия, образуя молекулы воды, то при эквивалентном соединении этих солей в растворе реакция среды будет нейтральная.
Определение степени гидролиза и рН раствора цианида калия
Задача 22.
Определите степень гидролиза и pH раствора цианида калия с молярной концентрацией 0,005 моль/л.
Решение:
Цианид калия – соль, образованная сильным основанием КОН и слабой кислотой HCN, которая в водном растворе гидролизуется по аниону:
CN– + HOH ⇔ HCN + OH– (ионно-молекулярная форма);KCN + HOH ⇔ KOH + HCN (молекулярная форма).
Таким образом, при гидролизе этой соли в растворе ее будет избыток ионов OH-, что придает раствору щелочную реакцию
(pH > 7 – среда щелочная).
Константа гидролиза соли, образованной слабой кислотой и сильным основанием определяется по формуле:
Kr = Kw/KD(кислоты)
Kw = 1 . 10-14 – ионное произведение воды.
KD(HCN) = 5 . 10-10 – константа диссоциации циановодородной кислоты
Константа гидролиза цианида калия равна:
Kr(KCN) = Kw/KD(HCN) = (1 . 10-14)/(5 . 10-10) = 2 . 10-5.
Находим степень гидролиза цианида калия, получим:
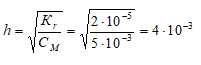
Рассчитаем молярную концентрацию ионов OH? в растворе, получим:
[OH–] = h . СM(KCN) = (4 . 10-3) . 0,005 = 2 . 10-5 моль/л.
Находим гидроксильный показатель, получим:
рОН = - lg[OH–] = – lg2 . 10-5 = 5 - lg2 = 5 - 0,30 = 4,7.
Находим водородный показатель, получим
рН = 14 – рОН = 14 – 4,7 = 9,3.
Ответ: рН = 9,3.

