"Химия. 11 класс". О.С. Габриелян (гдз)
Реакции гидролиза органических веществ и минеральных солей
Вопрос 1.
Примерами органических веществ, подвергающихся гидролизу, являются сахароза, бромметан, метиловый эфир муравьиной кислоты:
а) гидролиз сахарозы протекает в присутствии серной кислоты и при нагревании с образованием глюкозы и фруктозы:
C12H22O11 + H2O ↔ C6H12O6 + C6H12O6;
б) гидролиз бромметана протекает в присутствии едкого калия, при этом образуется метиловый спирт и бромоводород:
CH3Br + H2O ↔ CH3OH + HBr;
в) при гидролизе метилового эфира муравьиной кислоты образуется муравьиная кислота и метиловый спирт:
HCO—O—CH3 + H2O ↔ HCOOH + CH3OH.
Вопрос 2.
Гидролизу подвергаются соли, образованные сильным основанием и слабой кислотой, слабым основанием и сильной кислотой, слабым основанием и слабой кислотой. Водные растворы солей при этом могут иметь щелочную, кислую и нейтральную среды, соответственно.
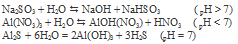
Вопрос 3.
Гидролизу по катиону подвергаются соли слабого основания и сильной кислоты:
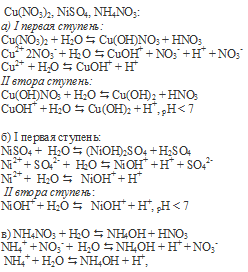
Вопрос 4.
Гидролиз по аниону подвергаются соли сильного основания и слабой кислоты: CaS, Na2SO3, K(HCOO):

Вопрос 5.
а) SrCl2 – соль сильного основания и сильной кислоты, поэтому не подвергается гидролизу.
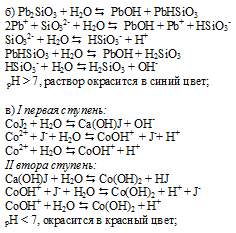
г) BaBr2 – соль сильного основания и сильной кислоты, поэтому не подвергается гидролизу. Реакция среды будет нейтральная, pH = 7, лакмус — фиолетовый.

з) NaJ – соль сильного основания и сильной кислоты, поэтому не подвергается гидролизу. Реакция среды будет нейтральная, pH = 7, лакмус — фиолетовый.
и) KNO3 – соль сильного основания и сильной кислоты, поэтому не подвергается гидролизу. Реакция среды будет нейтральная, pH = 7, лакмус — фиолетовый.
Вопрос 6.
Фенолфталеин окрашивает щелочные растворы в малиновый цвет. Окраска растворов при добавлении фенолфталеина изменится (станет малиновой) при добавлении его к растворам солей, образованных сильным основанием и слабой кислотой.
По условию задания это соли K2SO3 и NaCN.
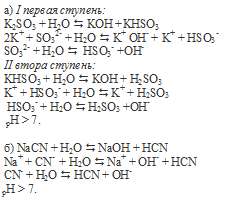
Вопрос 7.
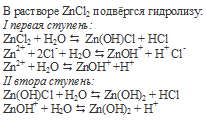
При гидролизе соли ZnCl2 в растворе образовалось небольшое количество соляной кислоты, которая прореагировала с металлическим цинком с образованием пузырьков газа водорода: Zn + 2HCl ↔ ZnCl2 H2↑
Вопрос 8.
Гидролизу и по катиону и по аниону подвергаются соли образованные слабой кислотой и слабым основанием. По условию задания это
соль (NH4)2SO3.
(NH4)2SO3 + 2H2O ↔ 2NH4OH + H2SO3
2NH4+ + SO32- + 2H2O ↔ 2NH4OH + H2SO3
Вопрос 9.
Уравнение реакции имеет вид:
3NaH2COH3 + AlH2(SOH4)H3 + 3HH2O ↔ 2Al(OH)H3↓ + 3COH2↑ + 3NaH2SOH4
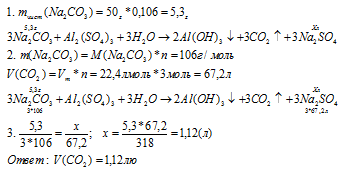
Вопрос 10.
Расположение солей в порядке возрастания кислотности среды их водных растворов:
Na2CO3, Na(CH3COO), Na(CH2ClCOO), NaNO3, NH4Cl.
Растворы солей Na2CO3, Na(CH3COO), Na(CH2ClCOO) имеют щелочную среду, поэтому они располагаются вначале; т.к. являются солями сильного основания NaOH и слабых кислот H2CO3, CH3COOH, CH2ClCOOH. Эти соли гидролизуются по аниону и поэтому образуют в растворах избыток ионов OH–, которые и придают раствору щелочную среду. H2CO3 — самая слабая из всех кислот, те. среда Na2CO3 — самая щелочная, то он находится первым в ряду, СН3СООН более сильная кислота, СН2СIСООН еще более сильная, среды Na(CH3COO) и Na(CH2ClCOO) менее щелочные, поэтому они располагаются следующими. NaNO3 – соль сильного основания (NaOH) и сильной кислоты (HNO3) имеет нейтральную среду, т.к. гидролизу не подвергается. NH4Cl — соль слабого основания (NH4OH) и сильной кислоты (HCl) гидролизуется по катиону с образованием избытка ионов водорода H+, что и придаёт раствору соли слабокислую среду.
Вопрос 11.
FeCl3 – соль слабого основания (Fe(OH)3 и сильной кислоты (HCl) гидролизуется по катиону с образованием избытка ионов водорода H+, что придаёт раствору соли слабокислую среду. При добавлении к раствору щёлочи NaOH или H2O уменьшится концентрация H+, что будет вести к усилению гидролиза соли. Равновесие реакции будет смещаться вправо.
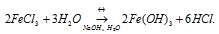
Добавление к раствору FeCl3 растворов HCl и ZnCl2, и металлического Zn ,будет вести к увеличению концентрации ионов водорода, что будет вести к ослаблению гидролиза.
Вопрос 12.
K2S – соль сильного основания и слабой кислоты гидролизуется по аниону с образованием ионов OH–, что придаёт раствору соли щелочную среду:
K2S + 2H2O ↔ 2KOH + H2S
Поэтому для подавления гидролиза нужно понизить кислотность, ввести дополнительно ионы OH–,например, раствор KOH. Можно уменьшить концентрацию самой соли K2S, а также понизить температуру.

