Вычисление степени гидролиза и константы диссоциации соли
Задача 591.
Сравнить степень гидролиза соли и рН среды в 0,1 М и 0,001 М растворах цианида калия.
Решение:
K(HCN) = 7,9 . 10-10.
KCN - соль сильного основания и слабой кислоты гидролизуется по аниону:
CN- + H2O ⇔ HCN + OH-.
Находим константу гидролиза:
Kr = К(Н2О)/K(HCN) =
= (1 . 10-14)(7,9 . 10-10) = 1,27 . 10-5.
Находим степень гидролиза соли, концентрацию гидроксид-ионов, рОН и рН в 0,1 М растворе:
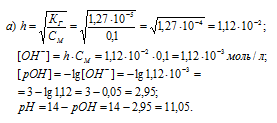
Находим степень гидролиза соли, концентрацию гидроксид-ионов, рОН и рН в 0,001 М растворе:
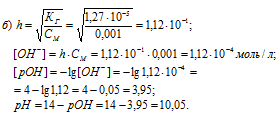
Ответ: а) в 0,1 М растворе h = 1,12 . 10-3; pH = 11,05;
б) в 0,001 М растворе h = 1,12 . 10-1; pH = 10,05.
Задача 592.
При 60 °С ионное произведение воды K(H2O) = 10-13. Считая, что константа диссоциации хлорноватистой кислоты не изменяется с температурой, определить рН 0,001 н. раствора KOCl при 25 и при 60 °С.
Решение:
K(НOCl) = 5 . 10-5.
Уравнение гидролиза KOCl:
OCl- = H2O ⇔ HOCl + OH-.
а) Находим константу гидролиза, степень гидролиза, концентрацию гидроксид-ионов, рОН и рН в 0,001 М растворе при t = 25 °С:
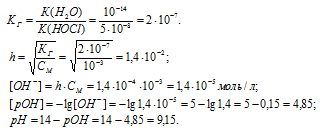
б) Находим константу гидролиза, степень гидролиза, концентрацию гидроксид-ионов, рОН и рН в 0,001 М растворе при t = 60 °С:
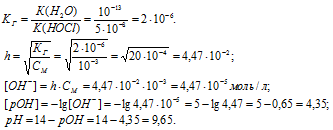
Ответ: pH = 9,15 (25 °С); pH = 9,65 (60 °С).
Задача 593.
рН 0,1 М раствора натриевой соли некоторой одноосновной органической кислоты равен 10. Вычислите константу диссоциации этой кислоты.
Решение:
Уравнение гидролиза соли будет иметь вид:
R- + H2O ⇔ HR + ОН-
Находим концентрацию ионов водорода:
pH = -lg[H+];
lg[H+] = 1 . -10;
[H+] = lg10 = 1 . 10-10 моль/л.
Находим концентрацию гидроксид-ионов:
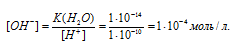
Рассчитаем степень гидролиза:
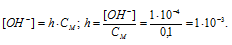
Теперь рассчитаем константу гидролиза:
КГ = h2 . CM =
= (1 . 10-3)2 . 0,1 = 1 . 10-7.
Рассчитаем K(HR):
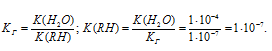
Ответ: 1 . 10-7.

