Расчет концентрации ионов металла в насыщенном растворе
Задача 571.
Во сколько раз уменьшится концентрация ионов серебра в насыщенном растворе AgCl, если прибавить к нему столько соляной кислоты, чтобы концентрация ионов Cl- в растворе стала равной 0,03 моль/л?
Решение:
Уравнение диссоциации AgCl имеет вид:
AgCl ⇔ Ag+ + Cl-;
ПР(AgCl) = [Ag+] + [Cl-] = 1,8 . 10-10.
Тогда
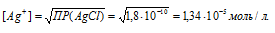
Поскольку [Ag+] = [Cl-], то после прибавления соляной кислоты концентрация ионов Ag+ и ионов Cl- стала равной 0,03 моль/л, т.е. [Ag+] = [Cl-] = 0,03 моль/л.
Рассчитаем уменьшение концентрации ионов Ag+:
0,03/(1,34 . 10-5) = 2239.
Ответ: в 2239 раз.
Задача 572.
Вычислить растворимость (в моль/л) CaF2 в воде и в 0,05 М растворе CaCl2. Во сколько раз растворимость во втором случае меньше, чем в первом?
Решение:
а) Вычисление растворимости соли CaF2 в воде
Обозначим искомую растворимость соли CaF2 через S (моль/л). Тогда в насыщенном растворе CaF2 содержится S моль/л) ионов Ca2+ и 2S (моль/л) ионов Cl-.
Отсюда
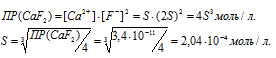
б) Вычисление растворимости соли CaF2 в 0,05 М растворе CaCl2
Находим растворимость соли CaF2 в 0,05М раствора CaCl2, обозначив её через S'. Концентрация ионов F- в насыщенном растворе будет равна 2S', а концентрация ионов Ca2+ составит (S' + 0,05) Поскольку S' << 0,05 величиной S' можно пренебречь и считать, что [Ca2+] = 0,05 моль/л. Тогда можно записать:
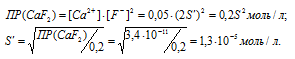
Находим, во сколько раз растворимость соли CaF2 уменьшилась в присутствии 0,05М раствора CaCl2:
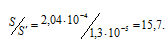
Ответ: а) 2,04 . 10-4 моль/л; б) 1,3 . 10-5 моль/л; в) в 15,7 раза.
Задача 573.
Во сколько раз растворимость AgCl в 0,001 н. растворе NaCl меньше, чем в воде? Расчет произвести с учетом коэффициентов активности, пользуясь табличными данными.
Решение:
Обозначим искомую растворимость соли через S(моль/л). Тогда в насыщенном растворе AgCl содержится S (моль/л) ионов Ag+ и S(моль/л) ионов Cl-.
Отсюда
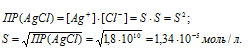
Выразим произведение растворимости соли AgCl через активности ионов:
Пр(AgCl) =  [Ag+] .
[Ag+] .  Cl-] =
Cl-] =
= {[Ag+] . [Cl-]} . {[fAg+] . [fCl-]}.
Обозначим искомую растворимость соли AgCl через S', находим, что [Ag+] = S' (моль/л), [Cl-] = S' ( + 0,001 моль/л). Поскольку S' << 0,001 моль/л, то величиной S' можно пренебречь и считать, что [Cl-] = 0,001 моль/л. Тогда можно записать:
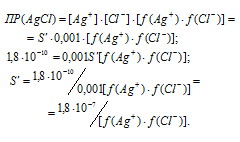
Для нахождения значений коэффициентов активностей ионов нужно вычислить значение ионной силы раствора сильного электролита NaCl:
I(NaCl) =
= 1/2[CM(Na+) . Z2(Na+) + CM(Cl-) . Z2(Cl-)] =
= 1/2[(0,001 . 12) + (0,001 . 12)] =
= 0,001 моль/л.
Согласно табличным данным при ионной силе раствора равной 0,001 коэффициенты активностей однозарядных ионов равны 0,98.
Тогда
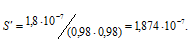
Рассчитаем, во сколько раз S' меньше, чем S:
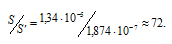
Ответ: в 72 раза.

