Как рассчитать количество электричества, для выделения из раствора на электродах водорода и кислорода
Задача 704.
Какое количество электричества потребуется для выделения из раствора: а) 2 г водорода; 6) 2 г кислорода?
Решение:
Эквивалентная масса водорода равна М/2 = 2/2 = 1г/моль, а кислорода – М/4 = 32/4 = 8г/моль.
Для расчета количества электричества (Q = It) используем уравнение Фарадея:
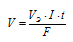
Здесь
V (m) - объем (масса) образовавшегося газообразного вещества; VЭ (Э) — эквивалентный объем газа; I — сила тока; t - время; F - постоянная Фарадея (96500 Кл/моль), т.е. количество электричества, необходимое для осуществления электрохимического превращения одного эквивалента вещества.
Решим уравнение закона Фарадея относительно количества электричества и подставим данные задачи, получим:
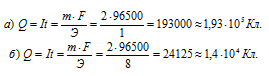
Ответ: а) 1,93 . 105 Кл; б) 2,4 . 104 Кл.
Задача 705.
При электролизе водного раствора Сг2(SO4)3 током силой 2 А масса катода увеличилась на 8 г. В течение какого времени проводили электролиз?
Решение:
Для расчета времени используем уравнение закона Фарадея:
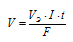
Здесь
V (m) - объем (масса) образовавшегося газообразного вещества; VЭ (Э) — эквивалентный объем газа (эквивалентная масса) ; I — сила тока; t - время; F - постоянная Фарадея (96500 Кл/моль), т.е. количество электричества, необходимое для осуществления электрохимического превращения одного эквивалента вещества.
Решим уравнение закона Фарадея относительно времени и подставим данные задачи:
(m = 8г, I = 2 A, Э = М/3 =
= 17,332г/моль), получим:
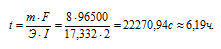
Ответ: 6,19 ч.
Задача 706.
При электролизе водного раствора SnCl2 на аноде выделилось 4,48 л хлора (условия нормальные). Найти массу выделившегося на катоде олова.
Решение:
Схема электродного процесса имеет вид:
Катод: Sn2+ + 2 = Sn0;
= Sn0;
Анод: 2Cl- - 2 = Cl2.
= Cl2.
Следовательно, эквивалентная масса олова равна М/2 = 118,710/2 = 59,355г/моль, а эквивалентный объём хлора равен:
VЭ(Сl2) = VM/2 =
= 22,4/2 = 11,2 моль/л.
Рассчитаем количество, выделившегося хлора:
n(Cl2) = V(Сl2)/VЭ(Сl2) =
= 4,48/11,2 = 0,4 моль/л.
Так как n(Sn) = n(Cl2), то массу олова рассчитаем по формуле:
m(Sn) = n(Sn) . MЭ(Sn) =
= 0,4 . 59,355 = 23,742 г.
Ответ: 23,742 г.
Задача 707.
За 10 мин из раствора платиновой соли ток силой 5 А выделил 1,517 г Рt. Определить эквивалентную массу платины.
Решение:
Для расчета эквивалентной массы платины используем уравнение закона Фарадея:
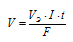
Здесь
V - объем образовавшегося газообразного вещества; VЭ — эквивалентный объем газа; I — сила тока; t - время; F - постоянная Фарадея (96500 Кл/моль), т.е. количество электричества, необходимое для осуществления электрохимического превращения одного эквивалента вещества.
Решим уравнение закона Фарадея относительно эквивалентной массы и подставим данные задачи:
(m = 1,517г, I = 5 A, t =
= 10 мин = 10 . 60 = 600с), получим:
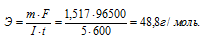
Ответ: 48,8 г/моль.

