Как рассчитать массу металла, выделившегося на электроде при электролизе его соли
Задача 696.
Никель в ряду напряжений стоит до водорода. Объяснить, почему возможно электролитическое выделение никеля из водных растворов его солей.
Решение:
Никель имеет стандартный электродный потенциал равный -0,250 В, что больше, чем электродный потенциал водородного электрода в нейтральной среде (-0,41 В), но меньше, чем для водородного электрода в кислой среде, то в зависимости от рН раствора, плотно-сти тока, концентрации ионов металла, возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода. На-пример, если рН раствора соли будет близка нейтральной, то разряжаться будет никель, так как его потенциал значительно положительнее потенциала водородного электрода (-0,41 В), а если раствор соли имеет кислую среду, то разряжаться будет водород, так как его потенциал (0,00 В) значительно положительнее потенциала металла (-0,250 В).
Задача 697.
Неочищенная медь содержит примеси серебра и цинка. Что произойдет с этими примесями при электролитическом рафиниронии меди?
Решение:
При электролитическом рафинировании меди применяют сульфат меди – наиболее дешёвая и распространённая соль меди. Неочищенные примеси в металлической меди, состоящие из цинка и серебра можно разделить на две группы: Zn – металл, имеющий значительно более отрицательный электродный потенциал (-0,763 В), чем медь (+0,337 В). Поэтому он анодно растворяется вместе с медью, но не осаждается на катоде, а накапливается в электролите у катодного пространства. В связи с этим электролит нужно периодически очищать от цинка.
Ag – благородный металл, не претерпевает анодного растворения, и в ходе процесса электролиза оседает у анода, образуя вместе с другими примесями анодный шлам, который можно извлечь.
Задача 698.
При электролизе раствора CuCl2 на аноде выделилось 560 мл газа (условия нормальные). Найти массу меди, выделившейся на катоде.
Решение:
Для расчета количества электричества используем формулу:
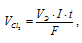
Получим
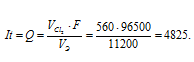
Теперь рассчитаем массу меди, выделившейся на катоде по формуле:
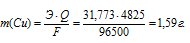
Здесь
Э – эквивалентная масса меди равная 31,773г/моль; F – постоянная Фарадея (96500 Кл/моль), т.е. количество электричества, необходимое для осуществления превращения одного эквивалента вещества; t – время, с; I – сила тока; VЭ – эквивалентный объём газа, для хлора он равен 11200 мл/моль; V – объём выделившегося газа, m – масса выделившегося вещества.
Ответ: 1,59г.
Задача 699.
Вычислить массу серебра, выделившегося на катоде при пропускании тока силой 6 А через раствор нитрата серебра в течение 30 мин.
Решение:
Схема электрохимического процесса: Ag+ - 1 = Ag+, поэтому эквивалентная масса Ag+ равна М/1 = 107,868/1 = 107,868 г/моль. Массу выделившегося серебра находим по формуле, имея в виду, что 30 мин = 1800 с:
= Ag+, поэтому эквивалентная масса Ag+ равна М/1 = 107,868/1 = 107,868 г/моль. Массу выделившегося серебра находим по формуле, имея в виду, что 30 мин = 1800 с:
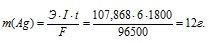
Здесь
Э – эквивалентная масса серебра; F – постоянная Фарадея (96500 Кл/моль), т. е. количество электричества, необходимое для осуществления превращения одного эквивалента вещества; t – время, с; I – сила тока; m – масса выделившегося вещества.
Ответ: 12 г.

