Использование уравнения Фарадея в расчетах при электролизе солей
Задача 708.
Чему равна эквивалентная масса кадмия, если для выделения 1 г калия из раствора его соли надо пропустить через раствор 1717 Кл электричества?
Решение:
Согласно закону эквивалентов при пропускании определённого количества электричества (Q = It) через раствор выделяется эквивалентная масса любого вещества. Для расчета эквивалентной массы кадмия используем уравнение закона Фарадея:
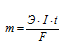
Здесь
m - масса образовавшегося или подвергшегося превращению вещества; Э — его эквивалентная масса; I — сила тока; t - время; F - постоянная Фарадея (96500 Кл/моль), т.е. количество электричества, необходимое для осуществления электрохимического превращения одного эквивалента вещества.
Решим уравнение закона Фарадея относительно эквивалентной массы и подставим данные задачи (m = 1г, I.t = 1717 Кл,), получим:
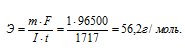
Ответ: 56,2 г/моль.
Задача 709.
При прохождении через раствор соли трехвалентного металла тока силой 1,5 А в течение ЗО мин на катоде выделилось 1,071 г металла. Вычислить атомную массу металла.
Решение:
Рассчитаем эквивалентную массу металла: Для расчета эквивалентной массы металла используем уравнение закона Фарадея:
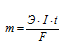
Здесь
m - масса образовавшегося или подвергшегося превращению вещества; Э — его эквивалентная масса; I — сила тока; t - время; F - постоянная Фарадея (96500 Кл/моль), т.е. количество электричества, необходимое для осуществления электрохимического превращения одного эквивалента вещества.
Решим уравнение закона Фарадея относительно эквивалентной массы и подставим данные задачи
(m = 1,071 г, I = 1,5 A, t = 30 мин = 30 . 60 = 1800 с), получим:
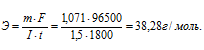
Теперь рассчитаем атомную массу металла по формуле:
Mr(Me) = Э . В = 38,28 . 3 = 114,835 г , т.е. Ar(Me) = 114,835.
Ответ: 114,835.
Задача 710.
Какой процесс протекает при электролизе водного раствора хлорида олова (II) на оловянном аноде: Sn → Sn2+ + 2 ; 2Cl- → Cl2 + 2
; 2Cl- → Cl2 + 2 ; 2H2O → O2 + 4H+ + 2
; 2H2O → O2 + 4H+ + 2 ?
?
Решение:
Стандартный электродный потенциал электрохимической системы Sn → Sn2+ + 2 (-0,126В) положительнее потенциала водородного электрода в нейтральной среде (-0,41В) незначительно. Поэтому на катоде будет выделяться олово
(-0,126В) положительнее потенциала водородного электрода в нейтральной среде (-0,41В) незначительно. Поэтому на катоде будет выделяться олово  0(Sn2+/Sn) >
0(Sn2+/Sn) > 0(2H+/H2)):
0(2H+/H2)):
Sn2+ 2 = Sn0
= Sn0
На аноде будет происходить электрохимическое окисление олова – материала анода, поскольку, отвечающий системе Sn → Sn2+ + 2 (-0,126В) значительно ниже 2Cl- → Cl2 + 2
(-0,126В) значительно ниже 2Cl- → Cl2 + 2 (+1,36В) и потенциала окисления воды (+1,228В) . Ионы хлора, движущиеся к аноду, будут накапливаться в анодном пространстве.
(+1,36В) и потенциала окисления воды (+1,228В) . Ионы хлора, движущиеся к аноду, будут накапливаться в анодном пространстве.
Таким образом, при электролизе водного раствора хлорида олова (II) на катоде в основном происходит разряд ионов Sn2+ и выделение металла. На аноде происходит противоположный процесс – окисление металла. В данном случае электролиз сводится к растворению металла анода и выделению его на катоде. Этот процесс можно применить для электрохимической очистки олова.
Ответ: а).

