Нахождение парциального давления газов и общего давления смеси
Задача 47.
0,350 г металла вытеснили из кислоты 209 мл водорода, собранного над водой при 20 °С и давлении 104,3 кПа. Давление насыщенного пара воды при этой температуре составляет 2,3 кПа. Найти эквивалентную массу металла.
Решение:
Парциальное давление кислорода равно разности общего давления и парциального давления паров воды:
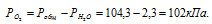
Обозначив искомый объём через и, используя объединённое уравнение закона Бойля- Мариотта и Гей-Люссака, находим V0:
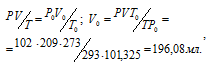
где
Р и V - давление и объём газа при температуре T = 293 К (273 + 20 = 293); P0 = 101,325 кПа; T0 = 273 К; = 102 кПа; V0 - объём газа при н.у..
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
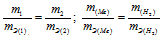
Мольный объём любого газа при н.у. равен 22,4 л. Отсюда эквивалентный объём водорода равен 22,4 : 2 = 11,2 л или 11200 мл. Тогда, используя формулу закона эквивалентов, рассчитаем эквивалентную массу металла:
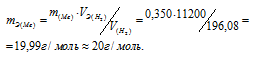
Ответ: m(Э) = 20 г/моль.
Задача 48.
250 мл водорода собраны над водой при 26 °С и давлении 98,7 кПа. Давление насыщенного пара воды при 26 °С составляет 3,4 кПа. Вычислить объем водорода при нормальных условиях и его массу.
Решение:
Парциальное давление кислорода равно разности общего давления и парциального давления паров воды:
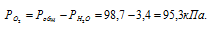
Обозначив искомый объём через V0 и, используя объединённое уравнение закона Бойля- Мариотта и Гей-Люссака, находим V0:
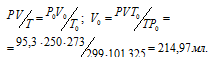
где
P и V - давление и объём газа при температуре T = 299 К (273 + 26 = 299); P0 = 101,325 кПа; T0 = 273 К; V0 = 95,3кПа; - объём газа при н.у..
Учитывая, что 1 г Н2 занимает 11200 мл рассчитаем массу водорода, содержащуюся в 214,97 мл, составив пропорцию:
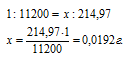
Ответ: 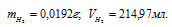
Задача 49.
0,604г двухвалентного металла вытеснили из кислоты 581 мл водорода, собранного над водой при 18 °С и давлении 105,6 кПа. Давление насыщенного пара воды при 18 °С составляет 2,1 кПа. Найти относительную атомную массу металла.
Решение:
Парциальное давление кислорода равно разности общего давления и парциального давления паров воды.
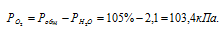
Обозначив искомый объём через V0 и, используя объединённое уравнение закона Бойля- Мариотта и Гей-Люссака, находим V0:
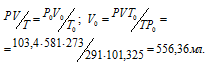
где
P и V - давление и объём газа при температуре T = 291 K (273 + 18 = 291); T0 = 273 К; P0 = 101,325 Kпа; V0 -объём газа при н.у.
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
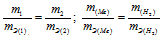
Мольный объём любого газа при н.у. равен 22,4 л. Отсюда эквивалентный объём водорода равен 22,4 : 2 = 11,2 л или 11200 мл. Тогда, используя формулу закона эквивалентов, рассчитаем эквивалентную массу металла:
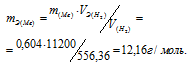
Молекулярная масса металла равна произведению эквивалентной массы на валентность его:
M(Me) = mЭ(Me) . B, где B - валентность металла. Тогда M(Me) = 12,16 . 2 = 24,32г/моль.
Ответ: M(Me) = 24,32г/моль.
Задача 50.
Сосуд наполнен смесью кислорода и азота. При каком соотношении парциальных давлений массы газов будут одинаковы:
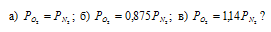
Решение:
Парциальным давлением любого газа в смеси называется давление, которое производил бы газ, занимая при тех же условиях объём всей газовой смеси.
Так как 1моль любого газа занимает одинаковый объём при одинаковых физических условиях (например, 22,4л при н.у.), следовательно, и парциальные давления 1-го моля любого газа при тех же физических условиях будут одинаковы.
Молекулярная масса кислорода больше молекулярной массы азота в 1,14 раза (32/!4 = 1,14), то при одинаковых массах данных газов, соответственно, парциальное давление азота будет в 1,14 раза меньше, чем у кислорода, т. е.:
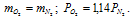
Ответ: б).
Задача 51.
Парциальное давление кислорода в воздухе равно 22 кПа. Чему равно содержание кислорода в процентах по объему: а) 42%; 6) 21%; в) 10,5%?
Решение:
Воздух представляет собой, в основном, смесь азота и кислорода. Для нахождения приведённого объёма кислорода, входящего в состав воздуха, приведённый к давлению смеси (Рвозд.) и температуре (Т) необходимо воспользоваться законом Бойля-Мариотта:
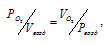
где
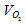 - объём кислорода; Vвозд. - объём воздуха; Рвозд. - общее давление смеси кислорода и азота (н.у.), 101,325 кПа;
- объём кислорода; Vвозд. - объём воздуха; Рвозд. - общее давление смеси кислорода и азота (н.у.), 101,325 кПа; 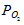 - парциальное давление кислорода, 22 кПа.
- парциальное давление кислорода, 22 кПа.
Сумма приведённых объёмов отдельных газов в смеси равняется общему объёму смеси, т. е.:
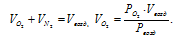
Отношение приведённых объёмов кислорода и азота к общему объёму воздуха называется объёмной долей и обозначается через r. Тогда:
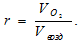
Следовательно, содержание кислорода в процентах по объёму в воздухе с учётом закона Бойля-Мариотта, равно:
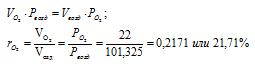
Ответ: б) 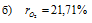
Задача 52.
Водород собирали в одном случае над водой, в другом над ртутью при одинаковых условиях. В обоих случаях объем газа оказался одинаковым. Одинаковы ли количества собранного водорода: а) одинаковы; б) количество водорода, собранного над ртутью, больше; в) количество водорода, собранного над водой, больше?
Решение:
Водород собирали над водой и над ртутью при одинаковых условиях при этом объёмы обеих систем оказались одинаковы. Учитывая, что ртуть имеет большую плотность, чем вода, то можно предположить, что количество водорода, собранное над ртутью будет больше, чем собранное над водой.
В обоих случаях объём газовой смеси будет складываться из определённого объёма водорода и паров жидкости, над которой собран газ. Так как температура кипения ртути и её плотность значительно выше, чем у воды, то в равных объёмах газов водорода будет содержаться больше над ртутью, так как ртути (её паров) будет в смеси значительно меньше, чем паров воды.
Таким образом, вследствие малой испаряемости ртути по отношению к воде парциальное давление паров ртути над жидкой ртутью будет меньше, чем парциальное давление паров воды над жидкой водой при одинаковых условиях и, следовательно, парциальное давление водорода над ртутью будет больше, чем над водой. Отсюда вытекает, что количество водорода, собранного над ртутью, больше, чем над водой.
Ответ: б).

