Пероксид водорода в окислительно-восстановительных реакциях
Решение задач по химии на составление уравнений реакций окисления-восстановления на примере пероксида водорода
Задание 325.
Какие свойства может проявлять пероксид водорода в окислительно-восстановительных реакциях? На основании электронных уравнений напишите уравнения реакций Н2О2: а) с Аg2O;б) с КI.
Решение:
В пероксиде водорода Н2О2 кислород находится в своей промежуточной степени окисления -1, поэтому в зависимости от условий он может быть как восстановителем (когда увеличивает свою степень окисления атом кислорода), так и окислителем (когда атом кисло-рода уменьшает свою степень окисления). Например:
а) Н2О2 + Ag2O = 2Ag + O2 + H2O
Уравнения электронного баланса:
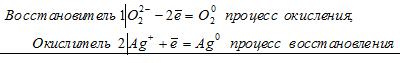
О22- + 2Ag+ = 2Ag0 + O20
Н2О2 + Ag2O = 2Ag + O2 + H2O
Здесь в пероксиде атом кислорода увеличивает свою степень окисления от -1 до 0, т.е. Н2О2 – восстановитель.
б) H2O2 + 2KI = K2O + I2 + H2O
Уравнения электронного баланса:
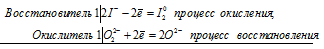
О22- + 2I- = I20 + 2O2-
H2O2 + 2KI = K2O + I2 + H2O
Здесь в пероксиде атом кислорода уменьшает свою степень окисления от -1 до -2, т.е. Н2О2 – окислитель.
Задание 326.
Почему пероксид водорода способен диспропорционировать (самоокисляться-самовосстанавливаться)? Составьте электронные и молекулярные уравнения процесса разложения Н2О2.
Решение:
Реакции самоокисления-самовосстановления (реакции диспропорционирования, дисмутации) протекают с одновременным уменьшением и увеличением степени окисления атомов одного и того же элемента в соединении. Поэтому эти реакции принципиально осуществимы лишь для тех соединений, в молекулах которых есть атомы со степенью окисления промежуточной между минимально и максимально возможной. Например, реакция самоокисления-самовосстановления:
2Н2О2 = 2Н2О + О2
Уравнения электронного баланса:
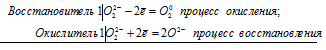
2О22- = О20 + 2O2-
В пероксиде водорода Н2О2 атом кислорода находится в своей степени окисления -1, про-межуточной между максимальной (0) и минимальной (-2).

