Запись окислительно-восстановительного процесса в молекулярной и ионной форме
Задача 639.
Закончить уравнения реакций, записать их в ионно-молекулярной форме:
а) FeSO4 + O2 + H2O ⇒
б) P + KMnO4 + H2O ⇒ KH2HO4 + K2HO4
в) Mn(NO3)2 + NaBiO3 + HNO3 ⇒ HMnO4 +
г) FeS2 + HNO3(конц.) ⇒ H2SO4 +
д) (NH4)2Cr2O7 ⇒ N2 +
Решение:
а) FeSO4 + O2 + H2O ⇒
Уравнения полуреакций:
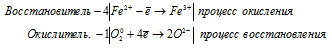
Ионно-молекулярная форма процесса:
4Fe2+ + O20 = 4Fe3+ + 2O2-.
4FeSO4 + O2 + 4H2O = 2Fe2O3 + 4H2SO4.
Полная ионно-молекулярная форма:
4Fe2+ + 4SO42- + O20 + 4H2O =
= 2Fe2O3 + 8H+ + 4SO42-.
Сокращённая ионно-молекулярная форма:
4Fe2+ + O20 + 4H2O = 2Fe2O3 + 8H+.
б) P + KMnO4 + H2O ⇒ KH2HO4 + K2HO4
Уравнения полуреакций:
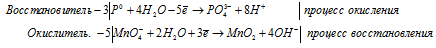
Ионно-молекулярная форма процесса:
3P0 + 5MnO4- + 22H2O =
= 3PO43- + 5MnO2 + 20OH- + 24H+.
После приведения членов в обеих частях равенства получим ионно-молекулярную форму:
3P0 + 5MnO4- + 2H2O = 3PO43- + 5MnO2.
Молекулярная форма процесса с учётом того, что продуктами являются KH2HO4 и K2HO4:
3P + 5KMnO4 + 2H2O = KH2HO4 + K2HO4 + 5MnO2.
Подставив коэффициент 2 к K2HO4 чтобы уравнять атомы калия и водорода, получим:
3P + 5KMnO4 + 2H2O = KH2HO4 + 2K2HO4 + 5MnO2.
в) Mn(NO3)2 + NaBiO3 + HNO3 ⇒ HMnO4 +
Уравнения полуреакций:
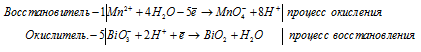
Ионно-молекулярная форма процесса:
Mn2+ + 5BiO3- + 4H2O + 10H+ =
= 5MnO4- + 5BiO2 + 8H+ + 5H2O.
Напишем молекулярную форму реакции с учётом данных задачи, получим:
Mn(NO3)2 + 5NaBiO3 + 2HNO3 =
= HMnO4 + 5BiO2 + 5NaNO3 + H2O.
Добавим в левую часть равенства одну молекулу HNO3 для уравнивания, получим окончательную молекулярную форму процесса:
Mn(NO3)2 + 5NaBiO3 + 3HNO3 =
= HMnO4 + 5BiO2 + 5NaNO3 + H2O.
Полная ионно-молекулярная форма процесса:
Mn2+ + 5NO3- + 5Na+ + 5BiO3- + 3H+ =
= MnO4- + H+ + 5BiO2 + 5Na+ + 5NO3- + H2O.
Сокращённая ионно-молекулярная форма процесса:
Mn2+ + 5BiO3- + 3H+ = MnO4- + H+ + 5BiO + H2O.
г) FeS2 + HNO3(конц.) ⇒ H2SO4 +
Уравнения полуреакций:
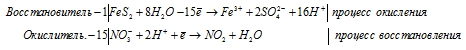
Ионно-молекулярная форма процесса:
FeS2 + 15NO3- + 8H2O + 30H+ =
= Fe3+ + 15NO2 + 2SO42- + 15H2O.
Приведём члены в обеих частях равенства, получим:
FeS2 + 15NO3- + 14H+ =
Fe3+ + 15NO2 + 2SO42- + 7H2O.
Напишем молекулярную форму реакции с учётом данных задачи, получим:
FeS2 + 15HNO3(конц.) =
= Fe(NO3)3 + 15NO2 + 2H2SO4 + 7H2O.
Для полного уравнивания добавим в левую часть равенства 3 моля HNO3, получим:
FeS2 + 18HNO3(конц.) =
= Fe(NO3)3 + 15NO2 + 2H2SO4 + 7H2O.
Полное ионно-молекулярное уравнение реакции имеет вид:
FeS2 + 18NO3- + 18H+ =
= Fe3+ + 3NO3- + 15NO2 + 4H+ + 2SO42- + 7H2O.
Сокращённое ионно-молекулярное уравнение:
FeS2 + 15NO3- + 14H+ =
Fe3+ + 15NO2 +2SO42- + 7H2O.
д) (NH4)2Cr2O7 ⇒ N2 +
Уравнения полуреакций:
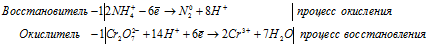
Ионно-молекулярная форма процесса:
2NH4+ + Cr2O72- + 14H+ =
= N20 + 2Cr3+ + 8H+ + 7H2O.
Приведём члены в обеих частях равенства, получим:
2NH4+ + Cr2O72- + 6H+ =
= N20 + 2Cr3+ + 7H2O.
Для уравнивания водорода отнимем 6 ионов Н+ и 3 молекулы Н2О, подставим 3 иона О2- к 2 ионам Cr3+, получим:
(NH4)2Cr2O7 ⇒ N2 + Cr2O3 + 4H2O.
Полное ионно-молекулярное уравнение, оно же будет и сокращенным ионным уравнением:
2NH4+ + Cr2O72- = N20 + Cr2O3 + 4H2O.

