Определение степени окисленности азота в химических соединениях
Задача 611.
Указать, в каких из приведенных процессов происходит окисление азота, и в каких — восстановление, как изменяется в каждом случае степень окисленности азота:
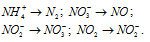
Решение:
Окисление – процесс, при котором происходит потеря элементом электронов и наблюдается повышение степени окисленности его. Восстановление – процесс, при котором элемент присоединяет электроны и наблюдается при этом понижение степени окисленности его.
а) Окисление азота происходит в следующих процессах:
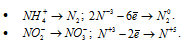
б) Восстановление азота происходит в следующих процессах:

Задача 612.
Какие из следующих реакций относятся к окислительно-восстановительным?
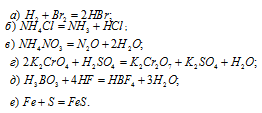
Решение:
Реакции, в к которых происходит изменение степеней окисленности элементов, называются окислительно-восстановительными.
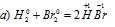
В данной реакции водород повышает степень окисленности 0 до +1, т.е. отдаёт электроны, является восстановителем. Бром понижает свою степень окисленности от 0 до -1, т. е. принимает электроны, является окислителем.
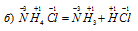
В данной реакции элементы не изменяют свои степени окисленности, значит, реакция не является окислительно-восстановительной.
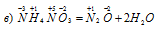
Азот повышает степень окисленности от -3 до +1, т. е. является восстановителем. Азот иона нитрата понижает свою степень окисленности от +5 до +1, т. е. является окислителем. Данная реакция относится к окислительно-восстановительным.
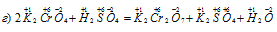
В данной реакции элементы не изменяют свои степени окисленности, значит, реакция не является окислительно-восстановительной.
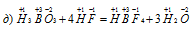
В данной реакции элементы не изменяют свои степени окисленности, значит, реакция не является окислительно-восстановительной.
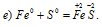
Железо повышает свою степень окисленности от 0 до +2, является восстановителем; сера понижает свою степень окисленности от 0 до -2, т.е. является окислителем. Таким образом, данная реакция является окислительно-восстановительной.
Ответ: а), в), е).
Задача 613.
Для следующих реакций указать, какие вещества и за счет каких именно элементов играют роль окислителей и какие — восстановителей:
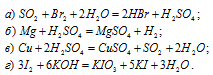
Решение:
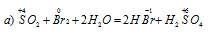
Уравнения ионно-молекулярного баланса:
Восстановитель 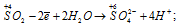 ; процесс окисления;
; процесс окисления;
Окислитель 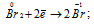 ; процесс восстановления.
; процесс восстановления.
В данной реакции оксид серы (IV) SO2 является восстановителем за счёт серы, которая отдаёт электроны и меняет степень окисленности от +4 до +6. Окислителем является бром Br2, в котором атомы брома присоединяют по одному электрону, меняя степень окисленности от 0 до -1.
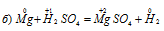
Уравнения ионно-молекулярного баланса:
Восстановитель 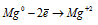 ; процесс окисления;
; процесс окисления;
Окислитель 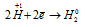 ; процесс восстановления.
; процесс восстановления.
В данной реакции окислителем является H2SO4, в которой атомы водорода, присоединяя по одному электрону, изменяют степень окисленности от +1 до 0. Магний является восстановителем, потому что его атомы, отдавая по два электрона, изменяют степень окисленности от 0 до +2.
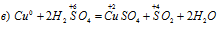
Уравнения ионно-молекулярного баланса:
Восстановитель 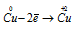 процесс окисления;
процесс окисления;
Окислитель 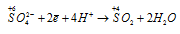 процесс восстановления.
процесс восстановления.
В данной реакции окислителем является H2SO4, в котором атом серы изменяет степень окисленности от +6 до +4. Восстановителем в данной реакции является медь, атомы которой отдают по два электрона, изменяя степень окисленности от 0 до +2.
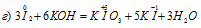
Уравнения ионно-молекулярного баланса:
Восстановитель 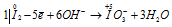 ; процесс окисления;
; процесс окисления;
Окислитель 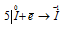 ; процесс восстановления.
; процесс восстановления.
В данной реакции окислителем и восстановителем является иод I2, в котором атом иода, отдавая пять электронов, изменяет степень окисленности от 0 до +5, и, присоединяя один электрон, изменяет степень окисленности от 0 до -1. в этой реакции происходит одновременно и увеличение, и уменьшение степени окисленности атомов одного и того же элемента, значит, эта реакция относится к реакциям диспропорционирования (самоокисления-самовосстановления).

