Определение молекулярной формулы вещества методом подбора
Во многих вариантах тестов ЕГЭ несколько лет подряд встречалась задача, имеющая принципиально иное, более сложное решение. Рассмотрим ее более подробно.
Задача 2.15.
Установите формулу неорганического соединения, содержащего 20,00% магния, 53,33% кислорода и 26,67% некоторого элемента.
Дано:
массовая доля магния:  (Мg) = 20,00% ;
(Мg) = 20,00% ;
массовая доля кислорода:  (О) = 53,33% ;
(О) = 53,33% ;
массовая доля неизвестного элемента:  (Э) = 26,67% .
(Э) = 26,67% .
Найти: формулу неорганического вещества.
Решение:
В состав неизвестного вещества входят магний, кислород и неизвестный элемент, символ которого мы обозначим «Э». Общую формулу можно записать так: МgхОуЭz.
Определим соотношение атомов в искомом веществе. Выберем его образец массой 100 г. В нем содержится 20 г магния; 53,33 г кислорода и 26,67 г неизвестного элемента. Найдем количество вещества каждого элемента в выбранном образце:
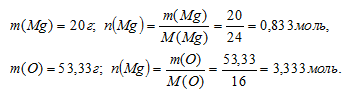
Количество вещества неизвестного элемента определить невозможно из-за отсутствия информации о его молярной массе.
Найдем соотношение магния и кислорода в формуле:
N(Mg) : N(О) = 0,833 : 3,333.
Выбираем наименьшее значение (в данном случае 0,833) и делим на него оба числа:
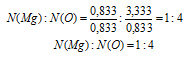
Но соотношение между количеством атомов «Э» и количеством атомов Мg или О нам неизвестно1. Поэтому мы не можем, как в предыдущей задаче определить его молярную массу. Попробуем «сконструировать» общую формулу искомого вещества, используя полученное соотношение магния и кислорода: (Мg1О4)xЭy. В данной формуле три неизвестные величины: х, у и молярная масса «Э». Сократить количество неизвестных можно с помощью расстановки степеней окисления у всех элементов:
(Мg1+2О4–2)xЭy.
Воспользуемся правилом, которое утверждает, что сумма степеней окисления всех атомов, входящих в состав нейтральной частицы должна быть равна «0». Оно позволит нам избавиться от одной неизвестной величины «у»:
(Мg1+2О4–2)x–6Э6+y.
В реальности степень окисления неизвестного элемента может оказаться иной в случае сокращения индексов, но такое упрощение позволит нам определить его молярную массу. Записываем выражение для определения молярной массы искомого вещества по общей формуле с учетом молярных масс известных элементов2:
M[Mg+2O4–2)x–6Э6+х] =
= (24+16 . 4) . x + M(Э) . 6 =
= (88х + М(Э) . 6).
Согласно полученному выражению, вклад массы неизвестного элемента в общую массу одного моль вещества составляет [М(Э) . 6] г. Это позволяет записать выражение для вычисления массовой доли неизвестного элемента:
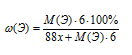
После упрощения и приведения подобных получаем математическое уравнение с двумя неизвестными:
23,47 . х = 4,4 . М(Э).
Оно имеет множество решений, и из них нам необходимо выбрать то, которое удовлетворяет физическому смыслу. «х» обозначает степень окисления неизвестного элемента и индекс в формуле, поэтому физическому смыслу могут соответствовать целые положительные числа от «1» до «8». Значение М(Э) должно соответствовать реальной молярной массе некоторого элемента из Периодической системы. Причем этот элемент должен удовлетворять химическому смыслу, т.е. проявлять использованную при расчете, степень окисления и образовывать соответствующее вещество.
Решение придется искать методом подбора, задавая значения «х» и вычисляя М(Э). Оформим его в виде таблицы:
| Значение «х» |
Значение «М(Э)» |
Выводы |
| 1 | 5,3 | Элемента с такой молярной массой в Периодической системе нет |
| 2 | 10,7 | Полученное значение практически совпадает с молярной массой бора. М(В) = 10,8 г/моль.Но для бора не характерна степень окисления (+2) и он не образует соединения (МgО4)В6 или после сокращения на «2» МgО4В3. |
| 3 | 16 | Соответствует молярной массе кислорода. Но кислород не проявляет степень окисления (+3) и его наличие уже учтено в формуле. |
| 4 | 21,3 | Элемента с такой молярной массой в Периодической системе нет. |
| 5 | 27,7 | Очень близка молярная масса алюминия М(А1) = 27 г/моль. Но он не проявляет степень окисления (+5). |
| 6 | 32 | Соответствует молярной массе серы. Она способна проявлять степень окисления (+6). Формула вещества будет: (МgО4)6S6 или после сокращения индексов на «6» МgО4S. Записывая в более привычном виде, отражающем химическую суть вещества, получаем соль — сульфат магния: МgSО4. |
| Дальнейший перебор значений «х» не приводит к более подходящему результату. | ||
Ответ: MgSO4.
В содержании верного ответа инструкции для проверяющих часть С тестов ЕГЭ был приведен ошибочный вариант решения данной задачи. В нем сразу после определения соотношения атомов магния и кислорода записана общая формула неизвестного вещества в виде: МgЭxО4 В ней совершенно не учтено, что на «х» атомов «Э» может приходиться увеличенное количество атомов магния и кислорода (MgO4)yЭх. При этом соотношение магния и кислорода остается 1:4. Так, например, в К2SО4 соотношение калия и кислорода 1 : 2, и на один атом серы приходится удвоенное, по сравнению с соотношением, количество калия и кислорода (КО2)2S.
Весь дальнейший расчет в данной инструкции строился на неверной общей формуле. Он привел к верному ответу лишь потому, что в истинной формуле искомого вещества на «х» атомов неизвестного элемента приходится именно 1 атом магния и 4 атома кислорода, что совершенно неоднозначно, как показал пример с сульфатом калия. В условии этот факт тоже не был оговорен. Соответственно, в правильном решении необходимо было учитывать любое соотношение индексов группы магния и кислорода с неизвестным элементом. Решение данной задачи было возможно только методом подбора, как это было показано.
Задачи на установление молекулярной формулы вещства:
1. Определение молекулярной формулы алкена
2. Определение молекулярной формулы углеводорода
3. Определение молекулярной формулы формальдегида
Комментарии:
1В задаче 2.14 было указано, что количество атомов неизвестного элемента в формуле равно количеству атомов одного из известных элементов.
2 Реальная молярная масса может отличаться в несколько раз от полученного выражения, т.к. в реальной формуле индексы могут быть сокращены.

