Как определить молекулярную формулу органического соединения
В некоторых задачах элементный состав искомого вещества не очевиден из текста условия. Чаще всего это касается реакций горения органических веществ. Неопределенность состава обычно связана с возможностью наличия кислорода в сгоревшем веществе. В первом шаге решения таких задач необходимо путем расчета выявить элементный состав искомого вещества.
Задача 2.11.
В результате сжигания 1,74 г органического соединения получено 5,58 г смеси СО2 и Н2О. Количества веществ СО2 и Н2О в этой смеси оказались равными. Определите молекулярную формулу органического соединения, если относительная плотность его паров по кислороду равна 1,8125.
Дано:
масса органического соединения: mорг в.ва = 1,74 г;
суммарная масса продуктов р-ции: m(СО2) + m(Н2О) = 5,58 г;
соотношение количеств веществ продуктов р-ции: n(СО2) = n(Н2О);
относительная плотность паров исходного вещества по кислороду: D(O2) = 1,8125.
Найти: молекулярную формулу сгоревшего соединения.
Решение:
Шаг 1. Класс сгоревшего органического соединения не указан, поэтому об элементном составе можно судить только по продуктам реакции. Углерод и водород входили в состав сгоревшего вещества однозначно, так как эти элементы присутствуют в продуктах горения, а из воздуха принимал участие в реакции только кислород. Причем весь углерод и весь водород полностью перешли из исходного вещества в СО2 и Н2О. Возможно, в состав искомого соединения также входил кислород.
Прояснить ситуацию с наличием или отсутствием кислорода можно по данным из условия задачи. Нам известна масса сгоревшего органического соединения и количественные данные,
относящиеся к продуктам. Очевидно, что если суммарная масса углерода из СО2 и водорода из Н2О окажется равной массе исходного органического вещества, то кислорода в его составе не было. В ином случае, если
m[(С)(в СO2)] + m[(Н)(в Н2О)] > mорг. в-ва
кислород входил в состав исходного вещества, причем его масса определится по разности:
mорг. в-ва – m(С)(в СО2) – m(Н)(в Н2О) = m(O)(в исх. в-ве).
Определим массу углерода и водорода в продуктах реакции и сравним ее с массой исходного вещества.
1. В условии указана информация о суммарной массе продуктов реакции, и поэтому, в первую очередь, нам необходимо выявить массы каждого из продуктов по отдельности. Для этого обозначим количество вещества образовавшегося углекислого газа величиной «а». Тогда, согласно условию:
n(СО2) = n(Н2О) = а моль.
Используя величину «а» как известную, найдем массу СО2 и Н2О:
m(СО2) = М(СО2) . n(СО2) = (44 . а) г,
m(Н2О) = М(Н2O) . n(Н2О) = (18 . а) г.
Суммируем полученные выражения и приравниваем к значению общей массы продуктов реакции из условия:
(44 . а) + (18 . а) = 5,58.
Получили математическое уравнение с одним неизвестным. Решая его, находим значение неизвестной величины: а = 0,09.
Этим значением мы обозначали количество вещества каждого из продуктов:
n(СО2) = n(Н2О) = 0,09 моль.
2. Найдем массу углерода в СО2 по алгоритму:
n(СO2) → n(С)(в СО2) → m(С)(в СО2);
n(С)(в СO2) = n(СO2) =
= 0,09 моль (по индексам в формуле);
m(С)(в СO2) = n(С)(в СO2) . М(С) =
= 0,09 . 12 = 1,08 г = m(С)(в исх. в-ве).
3. Найдем массу водорода в образовавшейся воде по алгоритму:
n(Н2О) → n(Н)(в Н2О) → m(Н)(в Н2О);
n(Н) (в Н2О) > n(Н2О) в 2 раза (по индексам в формуле);
n(Н)(в Н2О) = 2 . n(Н2О) = 2 . 0,09 = 0,18 моль;
m(Н)(в Н2O) = n(Н)(в Н2O) . М(H) =
= 0,18 . 1 = 0,18 г =m(Н)(в исх. в-ве).
4. Сравниваем суммарную массу углерода и водорода с массой исходного вещества:
m(С)(в СO2) + m(Н)(в Н2О) = 1,08 + 0,18 = 1,26 г;
m орг. в-ва = 1,74 г.
m(С)(в СO2) + m(Н)(в Н2О) > mорг. в.в-а,
следовательно, кислород входит в состав исходного вещества.
m(О)(в исх. в-ве) =
= mорг. в-ва – m(С)(в СО2) – m(Н)(в Н2О) =
= 1,74 -1,26 = 0,48 г.
5. Итак, в исходном веществе содержится: углерод, водород и кислород.
Дальнейшие действия ничем не отличатся от примеров ранее рассмотренных задач. Обозначим искомое вещество как СхНуОz.
Шаг 2. Составим схему реакции горения:
СхНуОz. + О2 → СО2 + Н2О.
Шаг 3. Определим соотношения количеств вещества (n) углерода, водорода и кислорода в исходном образце органического вещества. Количество вещества углерода и водорода мы уже определили в первом шаге.
Количества вещества (n) кислорода найдем по данным о его массе:
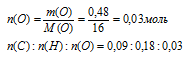
Шаг 4. Находим простейшую формулу:
N(С) : N(Н) : N(О) = 0,09 : 0,18 : 0,03.
Выбираем наименьшее значение (в данном случае «0,03») и делим на него все три числа:
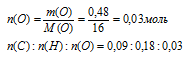
Получили набор наименьших целых чисел:
N(С) : N(Н) : N(О) = 3 : 6 :1.
Это дает возможность записать простейшую формулу: С3Н6О1
Шаг 5. Выявление истинной формулы.
По данным об относительной плотности паров искомого вещества по кислороду определяем истинную молярную массу:
Mистин.= D(О2) . М(О2) = 1,8125 . 32 = 58 г/моль.
Определим значение молярной массы для простейшей формулы:
Мпрост. = 3 . 12 + 6 . 1 +1 . 16 = 58 г/моль.
Мпрост.= Mистин. следовательно, простейшая формула является истинной.
С3Н6О — молекулярная формула сгоревшего вещества.
Ответ: С3Н6О.

