Определение молекулярной формулы формальдегида
В некоторых задачах на установление формулы вещества основная трудность заключается в определении элементного состава.
Задача 2.14.
Соединение содержит 40% углерода, 6,67% водорода по массе и еще один элемент, число атомов которого в молекуле равно числу атомов углерода. Относительная плотность соединения по водороду равна 15. Определите молекулярную формулу соединения.
Дано:
массовая доля углерода:  (С) = 40%;
(С) = 40%;
массовая доля водорода:  (Н) = 6,67%;
(Н) = 6,67%;
относительная плотность паров по водороду: D(Н2) = 15;
количество атомов неизвестного элемента в формуле равно количеству атомов углерода.
Найти: молекулярную формулу вещества.
Решение:
Шаг 1. В состав искомого вещества входят углерод, водород и некоторый неизвестный элемент, символ которого мы обозначим «Э». Общая формула будет иметь вид: СхНуЭх. Индексы у углерода и неизвестного элемента, согласно условию, одинаковы.
Шаг 2. Указание на химическую реакцию отсутствует.
Шаг 3. Определение соотношения атомов в искомом веществе.
Сначала вычислим массовую долю неизвестного элемента:
(Э) = 100% – (С) - (Н) =
= 100% –40% –6,67% =53,33%.
Выберем образец массой 100 г. В нем содержится 40 г углерода, 6,67 г водорода и 53,33 г неизвестного элемента. Определим количество вещества (л, моль) каждого из элементов
в выбранном стограммовом образце:
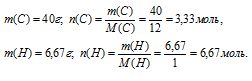
Молярную массу неизвестного элемента мы пока не знаем, и поэтому по соотношению 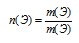
определить его количество вещества не удастся. Но в условии сказано, что число атомов неизвестного элемента в формуле искомого вещества равно числу атомов углерода. Следовательно: n(С) = n(Э) = 3,33 моль.
Теперь по значениям m(Э) и n(Э) во взятом образце можно вычислить молярную массу неизвестного элемента, которая дает нам возможность «узнать» элемент:
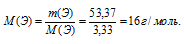
По Периодической системе находим элемент с молярной массой 16 г/моль. Это — кислород. Запишем соотношение количеств вещества (n) элементов в выбранном стограммовом образце:
n(С) : n(Н) : n(О) = 3,33 : 6,67 : 3,33.
Шаг 4. Находим простейшую формулу:
N(С) : N (Н) : N(О) = 3,33 : 6,67 : 3,33.
Выбираем наименьшее значение (в данном случае 3,33) и делим на него все три числа:
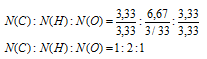
Получили набор наименьших целых чисел. Это позволяет нам записать простейшую формулу: С1Н2О1.
Шаг 5. Выявление истинной формулы.
По данным об относительной плотности паров искомого вещества по водороду определяем истинную молярную массу.
Воспользуемся соотношением:
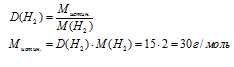
Определим значение молярной массы для простейшей формулы:
Мпрост.= 1.12 + 2 . 1 + 1 . 16 = 30 г/моль.
Истинная молярная масса совпадает с молярной массой простейшей формулы, следовательно, индексы в простейшей формуле увеличивать не надо. Простейшая формула совпадает с истинной молекулярной формулой: С1Н2O1.
Вещество с такой формулой действительно существует. Это — формальдегид (метаналь): Н2С=О.
Ответ: Н2С=О.

