Методы умозрительного анализа и простого перебора при установлении формулы вещества
Рассмотрим проблемную задачу, которая встречалась во многих вариантах тестов ЕГЭ на протяжении нескольких последних лет. Она имеет неоднозначное решение.
Задача 2.16.
Сложный эфир массой 30 г подвергнут щелочному гидролизу. При этом получено 34 г натриевой соли предельной одноосновной кислоты и 16 г спирта. Установите молекулярную формулу этого эфира.
Анализ условия этой задачи позволяет записать следующую общую формулу сложного эфира: (СхН2хСОО)kСуНz. Здесь присутствуют 4 неизвестных параметра «х»; «у», «z» и «k».
Указание на одноосновность и предельность карбоновой кислоты позволяет записать кислотный остаток, входящий в состав эфира, с использованием одной переменной: (СxН2xСОО–).
Тип образующегося спирта в условии не указан, следовательно, он может быть, согласно школьной программе, предельным и непредельным, одноатомным и многоатомным.
Возможность существования в молекуле спирта нескольких гидроксильных групп приводит к неопределенности количества остатков карбоновой кислоты в молекуле эфира. Это отражено неизвестным параметром «и» в его общей формуле. Использование неизвестных «у» и «у» связано с невозможностью определения соотношений атомов углерода и водорода в молекуле спирта по причине отсутствия информации о предельности спирта.
Такое количество неизвестных параметров в формуле эфира не позволяет по приведенным в условии данным решить эту задачу. Более того, путем подбора возможных вариантов удалось найти, по меньшей мере, формулы двух эфиров, удовлетворяющих условию задачи:
НСОО–СН3 — сложный эфир, образованный метиловым спиртом и муравьиной кислотой;
(НСОО)8С9Н12 — сложный эфир образованный предельным восьмиатомным спиртом и муравьиной кислотой.
Для решения данной задачи во время тестирования необходимо было сделать предположение об одноатомности и предельности образующегося спирта. Ниже приведено несколько вариантов решения с учетом такого предположения.
Решение (I способ).
Шаг 1. В состав сложного эфира входят те же элементы, из которых состоит получающийся в результате гидролиза спирт и кислотный остаток карбоновой кислоты. Это углерод, водород и кислород. Общую формулу эфира удобно составить с учетом образующихся в химической реакции продуктов, так как во взаимодействии участвовали только функциональные группы.
Указание на одноосновность и предельность кислоты позволяет нам использовать общую формулу этого гомологического ряда, в которой лишь одна неизвестная величина «х»: CxH2x+1COOH.
Сделанное предположение о предельности и одноатомности спирта дает возможность записать его формулу тоже с применением лишь одной переменной. Обозначим ее «у»: CyH2y+1OH.
Таким образом, общая формула искомого эфира будет: CxH2x+1COO–CyH2y+1.
Шаг 2. В результате гидролиза получилась натриевая соль карбоновой кислоты, следовательно, для реакции, гидролиза использовали NаОН.
CxH2x+1COO–CyH2y+1 + NаОН →
→ CxH2x+1COONa + CyH2y+1OH.
Шаг 3 и 4. Приведенные в условии данные не позволяют в этих шагах определить соотношения всех элементов и простейшую формулу эфира.
Шаг 5. Для выявления значений «х» и «у» в истинной формуле эфира необходимо сопоставить массы участвующих в реакции веществ, данные о которых фигурируют в условии.
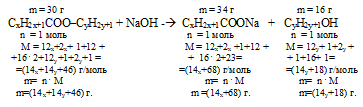
Составляем 2 пропорции:
30 г эфира дают 34 г соли (по уравнению);
(14х + 14у + 46) г эфира дают (14x + 68) г соли (по условию).
Из этой пропорции получаем первое математическое уравнение:
30 . (14x + 68) = 34 . (14x + 14у + 46).
Приводим подобные и упрощаем его. В результате получаем:
56x + 476у = 476.
30 г эфира дают 16 г спирта (по уравнению);
(14х + 14у +46) г дают (14x = 18) г спирта (по условию).
Из 2-й пропорции получаем второе математическое уравнение:
30 . (14x + 18) = 16 . (14x + 14у + 46).
После упрощения оно принимает вид:
224x + 196у = 196.
Объединяем два математических уравнения в систему:
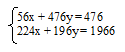
Решая эту систему, получаем х = 0; у = 1.
Подставим значения х и у в общую формулу эфира: C0H1COO–CH3. Индекс «0» у углерода обозначает отсутствие его в радикале, связанном с карбоксильной группой у кислоты. Следовательно, эфир состоял из остатка муравьиной кислоты и метанола: НСОО–СН3.
Ответ: НСОО–СН3.
Математическую часть решения последней задачи можно было значительно упростить. Для этого достаточно проанализировать первое получившееся уравнение. Из бесконечного количества его решений, физическому смыслу удовлетворяет лишь целые неотрицательные значения «х» и «у». Коэффициента перед «у» и свободный член совпадают, следовательно, единственным удовлетворяющим физическому смыслу решением является следующая пара значений: х =0; у = 1.
Получить их можно было не только путем умозрительного анализа, но и простым перебором, задавая значения «х» в виде неотрицательных целых чисел (начиная с 0), и вычислением значения «у». Уже первая операция перебора привела бы к результату. Интересно заметить, что при этом способе часть данных из условия (о массе одного, причем любого из веществ) не потребовалась. Но в тексте такого варианта решения необходимо обязательно обосновывать единственность ответа путем проведения нескольких операций перебора и
анализом полученных результатов.
При оформлении тестов ЕГЭ, во избежание ошибки проверяющего и необходимости апелляции, рекомендуется использовать более строгое решение с составлением системы математических уравнений. При этом приводить сам текст решения системы необязательно. Достаточно сразу указать значения переменных и записать искомую формулу.
Возможен и иной вариант решения данной задачи, предполагающий последовательный алгоритм действий.
Решение (II способ).
Анализ задачи и уравнение реакции, приведенные в 1 и 2 шагах предыдущего способа решения, остается прежним.
Схематично алгоритм дальнейшего решения можно представить следующим образом:
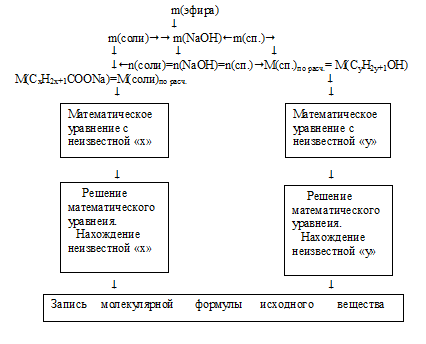
1. По уравнению реакции видно, что масса вступившего во взаимодействие NаОН легко определяется по разнице между продуктами и исходным эфиром:
m(NаОН) = m(соли) + m(спирта) – m(эфира) =
= 34 + 16 – 30 = 20 г.
2. Используя значение молярной массы NаОН, находим его количество вещества:
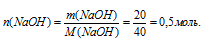
3. По уравнению реакции видно, что количество вещества NаОН, вступившего в реакцию, равно количеству вещества образовавшейся соли и спирта1.
n(NаОН) = n(соли) = n(спирта) = 0,5 моль.
4. Определяем молярную массу соли.
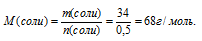
5. Находим значение «х» в формуле соли. Для этого запишем выражение для определения молярной массы по общей формуле с использованием молярных масс элементов:
М(СхН2х+1СОСNа) =
= 12х + 1 + 12 + 16 . 2 + 23 =
= (14х + 68) г/моль.
Приравниваем это выражение к значению молярной массы соли, полученному в предыдущем действии:
14х + 68 = 68.
Решение этого уравнения дает несколько неожиданный ответ:
x= 0.
Подставляем его в общую формулу соли и получаем: НСОONа — натриевая соль муравьиной кислоты. Индекс «0» у углерода указывает на его отсутствие в этой части формулы.
6. Используя массу образовавшегося спирта из условия и его количество вещества, определенное в 3 действии, находим значения молярной массы спирта.
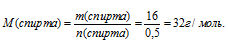
7. Находим значение «у» в формуле спирта. Для этого запишем выражение для определения его молярной массы по общей формуле с использованием молярных масс элементов:
M(CyH2y+1OH) =
= 12у + 2у + 1 + 16 + 1 =
= (14у + 18) г/моль.
Приравниваем это выражение к значению молярной массы спирта, полученному в предыдущем действии:
14y + 18 = 32.
Решая это уравнение, получаем:
у = 1.
Подставляем его в общую формулу спирта: СН3ОН.
8. Подставляем значения «х» и «у» в общую формулу эфира: НСОО–СН3 (метиловый эфир муравьиной кислоты).
Ответ: НСОО–СН3
В инструкции для проверяющих части С тестов ЕГЭ был приведен иной вариант решения данной задачи. Решение было разбито на три этапа, каждый из которых оценивался в 1 условный балл.
На первом этапе предполагается составление уравнение гидролиза эфира в общем виде без указания элементного состава:
RСООR* + NаОН → RСООNа + R*ОН.
Далее по разнице масс продуктов реакции и исходного эфира определяется масса NаОН:
m(NаОН) = m(RСОONа) + m(R*ОН) – m(RСООR*) = 34+ 16 – 30 = 20 г.
По массе NаОН находили его количество вещества:
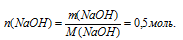
На втором этапе предполагается определение количества вещества эфира, вступившего в реакцию согласно уравнению:
n(RСООR*) = n(NаОН) = 0,5 моль.
По массе эфира из условия, находили его молярную массу:
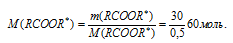
На третьем этапе предполагается определение молярных масс радикалов, входящих в состав эфира. Для этого предлагается из общей молярной массы эфира вычесть молярные массы известных элементов (одного углерода и двух атомов кислорода):
М(R) + М(R*) = 60 – 12 – 32 = 16 г/моль.
Из полученного значения суммы молярных масс радикалов (R) делается вывод об их составе. В качестве R выступает атом водорода, в качестве R* — метил (СН3). После чего записывается формула эфира: НСОО–СН3.
Данный путь решения последней задачи не является универсальным и применим только для единственного эфира (метилового эфира муравьиной кислоты). Для любого другого эфира пришлось бы определять молярные массы исходных веществ, как это сделано во втором способе. Решая задачу в условиях тестирования, когда мы не знаем ответа, разумно применять более универсальный алгоритм. Выберите наиболее понятный и близкий вам способ и используйте его при решении подобных задач. В случае, аналогичном вышеприведенному, не забывайте делать предположение об одноатомности и предельности спирта!
Задачи на установление молекулярной формулы вещства:
1. Определение молекулярной формулы алкена
2. Определение молекулярной формулы пентена
3. Определение молекулярной формулы формальдегида
Комментарии:
1Такой вывод можно сделать только на основании предположения об одноатомности спирта.

