Вычисление массовой доли сульфата магния
Задача 3.1.
Магний массой 4,8 г растворили в 200 мл 12%-ного раствора серной кислоты (р = 1,05 г/мл). Вычислите массовую долю сульфата магния в конечном растворе.
Дано:
масса магния: m(Мg) = 4,8 г;
объем исходного раствора Н2SО4: Vр-ра(Н2SО4) = 200 мл;
массовая доля Н2SО4 в исходном р-ре: (Н2SО4)в исх. р-ре = 12% ;
плотность исходного р-ра Н2SО4: р (Н2SО4)р-ра = 1,05 г/мл.
Найти: массовую долю MgSО4 в конечном растворе.
MgSО4 в конечном растворе.
Решение:
В условии описана единственная химическая реакция магния с разбавленной серной кислотой1:
Мg + Н2SО4(разб.) = МgSО4 + Н2.
Мы имеем данные о количествах двух исходных веществ, связанных одной химической реакцией. Это однозначно указывает на необходимость определения избытка - недостатка.
Алгоритм решения можно отразить следующим образом:
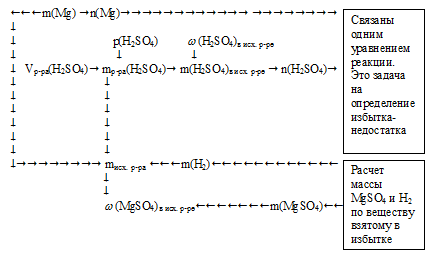
1. Определим количество вещества магния:
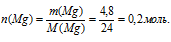
2. Определим массу раствора Н2SО4:
mр-ра(Н2SО4) = Vр-ра(Н2SО4) . рр-ра(Н2SО4) =
= 200 . 1,05 = 210 г.
3.Определим массу серной кислоты в 210 г раствора:
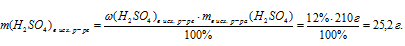
4. Определим количество вещества Н2SО4 в исходном растворе:
5. Определяем, какое вещество взято в недостатке.
Выберем за основу магний и определим по уравнению реакции количество Н2SО4 которое необходимо для расходования 0,2 моль Мg.
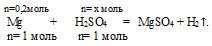
Составляем пропорцию:
на 0,2 моль Мg должно расходоваться х моль Н2SО4 (по условию);
на 1 моль Мg полностью расходуется 1 моль Н2SО4 (по уравнению);
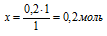 – Н2SО4 необходимо для полного растворения всего магния.
– Н2SО4 необходимо для полного растворения всего магния.
|
n(Н2SО4) необходимо |
n(Н2SО4) дано по условию |
|---|---|
|
0,2моль < 0,26 моль |
|
Серная кислота находится в избытке и расходуется не вся в процессе реакции. Поэтому дальнейшие расчеты по уравнению реакции будем проводить, используя данные по Мg, так как он в недостатке.
6. По значению количества вещества магния определяем массы образовавшейся соли МgSО4 и водорода.
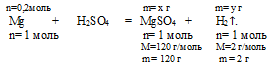
Составляем пропорцию:
на 0,2 моль Мg должно расходоваться х моль MgSО4 (по условию)
на 1 моль Мg полностью расходуется 1 моль MgSО4 (по уравнению)
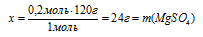
7. Определяем общую массу конечного раствора:
m исх. р-ра = m(Mg) + m исх. р-ра (Н2SО4) – m(Н2) =
= 4,8 + 210 – 0,4 = 214,4 г.
8. Определяем массовую долю МgSО4 в конечном растворе:
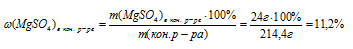
Ответ: m(МgSО4)в кон.р-ре = 11,2%.
Комментарии:
1Следует учитывать, что между магнием и концентрированной серной кислотой пойдет другая реакция, в которой окислителем будет сера из сульфатного иона:
4Мg + 5Н2SО4 = 4МgSО4 + Н2S↑ + 4Н2О.

